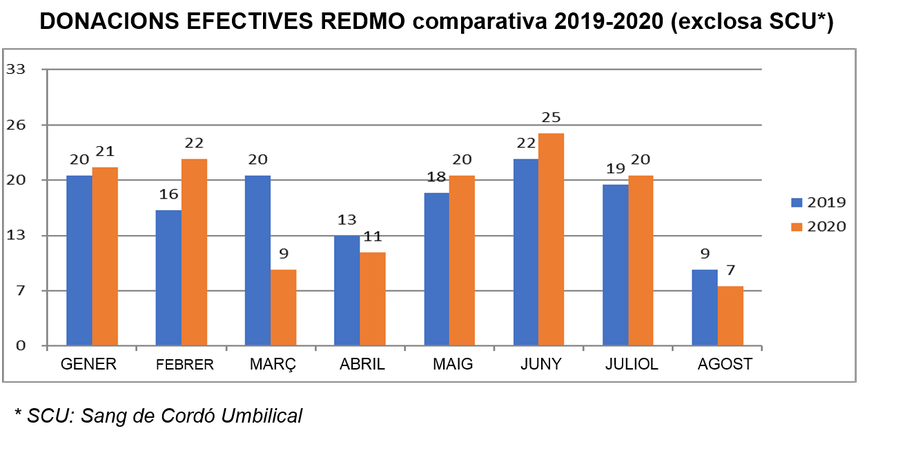
► En els primers vuit mesos de l’any, el Registre Espanyol de Donants de Medul·la Òssia (REDMO), gestionat per la Fundació Josep Carreras, va notificar un augment del 4,5% en el nombre de donants inscrits
► Les comunitats autònomes comuniquen una mitjana de 2.374 incorporacions mensuals a REDMO, fet que suposa 18.993 inscrits 2020
► L’Estat espanyol ha superat amb escreix els 400.000 donants previstos pel 2020 i s’acosta de mica en mica al mig milió, objectiu proposat per 2022
► Des que l’ONT posés en marxa el Pla Nacional de Medul·la Òssia el 2013, el nombre de donants registrats s’ha quadruplicat
► Tot i les dificultats generades per la COVID-19, durant l’Estat d’Alarma es van registrar 5.734 nous donants a REDMO i es van realitzar 45 donacions efectives
18 de setembre de 2020. La donació de medul·la òssia continua creixent a l’Estat espanyol. Tot i les complicades circumstàncies dels últims mesos, els ciutadans han demostrat un cop més la seva solidaritat i, durant els primers vuit mesos de l’any, un total de 18.993 persones s’han registrat com a donants de medul·la. Amb aquestes noves incorporacions, el Registre Espanyol de Donants de Medul·la Òssia (REDMO), gestionat per la Fundació Josep Carreras en coordinació amb l’ONT i les comunitats autònomes, ja compta amb prop de 434.000 persones inscrites.
Aquestes dades, recollides per l’Organització Nacional de Trasplantaments (ONT) i REDMO, representen un augment del 4,5% en el nombre d’inscrits com a donants de medul·la òssia a 31 d’agost de 2020 i suposen una mitjana de 2.374 incorporacions mensuals (uns 80 nous donants a el dia).
L’Estat espanyol s’acosta a bon ritme als 500.000 donants el 2022, en línia amb els objectius establerts pel Pla Nacional de Medul·la Òssia (PNMO). En aquest sentit, Espanya ja va superar, gairebé dos anys abans del previst, els 400.000 donants marcats com a meta pel 2020. En l’actualitat el registre mundial de donants, que inclou tots els registres nacionals, compta amb més de 37 milions de donants i 800.000 unitats de sang de cordó umbilical, entre els quals es realitzen les recerques internacionals per a qualsevol pacient que ho necessiti.
Des que es posés en marxa aquest Pla al començament de 2013, el nombre de donants inscrits al nostre país s’ha multiplicat per quatre. En la seva última fase, el PNMO afegeix entre els seus objectius la millora qualitativa, centrada en rejovenir el registre i en la incorporació de donants homes.
En l’actualitat, el 63% de tots els donants registrats són dones davant de 37% d’homes. Aquesta tendència es manté durant els primers mesos de 2020: set de cada 10 nous registres són donants dones. No obstant això, les possibilitats que un home arribi a ser donant efectiu tripliquen les de les dones, ja que són els més sol·licitats pels equips, al relacionar la seva donació amb millors resultats després del trasplantament.
L’ONT reconeix l’important esforç de les comunitats autònomes, tant des del punt de vista econòmic com en recursos humans, per aconseguir aquests resultats. Des del seu inici, el PNMO ha comptat amb finançament tant de l’Administració Central com de l’Autonòmica, que han pagat conjuntament el cost dels tipatges dels donants. En concret, el Ministeri de Sanitat ha destinat 7,3 milions d’euros des de 2013 per al desenvolupament d’aquest Pla.
IMPACTE DE LA COVID-19
En els primers vuit mesos de l’any, el nombre de donants de medul·la inscrits ha crescut fins als 18.993, tot i les dificultats que ha generat la crisi sanitària provocada per la COVID-19, una xifra propera als 22.006 donants que es van inscriure a al llarg de el mateix període del 2019. les dades reflecteixen que l’activitat de donació en els últims quatre mesos s’assembla a la de l’any anterior.
Gràcies a la solidaritat de la ciutadania i a la tasca realitzada pel personal que forma la xarxa de donació i trasplantament de medul·la òssia al nostre país, durant l’Estat d’Alarma, entre el 13 de març i el 21 de juny de 2020, es van registrar un total de 5.734 de donants de medul·la i es van produir 45 donacions efectives.
‘UnMatchxUnaVida’
Fa un any, amb motiu de l’anterior Dia Mundial del Donant de Medul·la Òssia, l’ONT, la Fundació Josep Carreras i les 17 Coordinacions Autonòmiques de Trasplantaments presentaven la campanya ‘Un Match x Una Vida’ per fomentar la donació de medul·la i atreure a potencials donants d’entre 18 i 40 anys, especialment homes, per ajudar a assolir els 500.000 donants registrats a REDMO.
La iniciativa compta amb un web (www.unmatchxunavida) i amb perfils oficials en diverses xarxes socials. En el si de la campanya, s’han dut a terme diferents accions de street màrqueting, amb instal·lació d’stands informatius en 17 ciutats espanyoles entre octubre de 2019 i gener de 2020.
Durant aquests mesos, milers de joves van mostrar el seu interès i van voler informar-se sobre la donació de medul·la òssia, culminant en molts casos amb la seva incorporació a REDMO. En total, entre octubre i gener, es van produir 13.564 noves inscripcions.
La repercussió mediàtica de la campanya es va traduir en més de 50.000 reproduccions de el vídeo promocional, 4.000 seguidors en xarxes socials i més de 1.000.000 d’impressions entre el conjunt de les publicacions. Es van produir, a més, més de 170 aparicions en premsa, ràdio i televisió. Així mateix, van arribar i van ser contestades més de 1.000 qüestions sobre medul·la òssia.
L’ONT i la Fundació Josep Carreras han volgut fer públic aquestes dades coincidint amb el Dia Mundial del Donant de Medul·la Òssia que se celebra demà, 19 de setembre, amb diferents actes organitzats per les associacions de pacients a tot el país, en els quals es tracta de retre un homenatge als donants de medul·la de tot el món.
Els integrants del PNMO (ONT, comunitats autònomes, Fundació Internacional Josep Carreras – REDMO, Societat Espanyola d’Hematologia i Hemoteràpia i associacions de pacients) agraeixen als ciutadans espanyols la seva generositat i els animen a informar-se sobre la importància d’aquest tipus de donació. Podeu consultar la pàgina web de la campanya “UnMatchxUnaVida” en què es recullen totes les dades, així com els centres de referència on poden fer-se donants: http://www.unmatchxunavida.com/