Els assajos clínics
Els assajos clínics són estudis mèdics en els quals participen persones sanes o pacients. Aquests assajos permeten trobar noves formes segures i eficaces per prevenir, detectar o tractar malalties.
La informació proporcionada a www.fcarreras.org serveix per donar suport, no reemplaçar-la, a la relació que existeix entre els pacients/visitants d’aquest lloc web i del seu metge.
Què és un assaig clínic?
 Els assajos clínics són una part fonamental dins de l’espectre d’investigació mèdica. Normalment, la idea d’un assaig clínic acostuma a aparèixer en un laboratori. Quan els investigadors han avaluat un nou tractament o procediment en el laboratori i en animals d’experimentació, els més prometedors passen a ser considerats per a assajos clínics. A mesura que els estudis passen una sèrie de passos, anomenats fases, els investigadors obtenen més informació sobre el tractament, els seus riscs i la seva eficàcia.
Els assajos clínics són una part fonamental dins de l’espectre d’investigació mèdica. Normalment, la idea d’un assaig clínic acostuma a aparèixer en un laboratori. Quan els investigadors han avaluat un nou tractament o procediment en el laboratori i en animals d’experimentació, els més prometedors passen a ser considerats per a assajos clínics. A mesura que els estudis passen una sèrie de passos, anomenats fases, els investigadors obtenen més informació sobre el tractament, els seus riscs i la seva eficàcia.
Cada assaig clínic té criteris que descriuen qui hi pot participar: nen i/o adults, pacients o voluntaris sans, persones amb antecedents ètnics i racials que les fan més proclius a determinades malalties, etc. Tots els assajos clínics segueixen un pla dissenyat curosament (o protocol) per protegir la salut i respondre a preguntes específiques de la investigació. En el protocol es descriu el que es farà en les persones incloses i què poden esperar de l’equip d’investigació. És important comprendre els riscos els beneficis de la participació abans d’unir-se a un assaig. Els participants dels assajos clínics també tenen dret i proteccions.
Quina finalitat tenen els assajos clínics?
Els assajos clínics poden tenir diferents objectius que permeten distingir:
- Assajos conductuals. Avaluen o comparen maneres de promoure canvis de conducta destinats a millorar la salut.
- Assajos de diagnòstic. Estudien o comparen proves o procediments per diagnosticar una malaltia o afecció determinada.
- Assajos de prevenció. Busquen millors maneres de prevenir una malaltia en persones que no l’han tingut mai o de prevenir la seva reaparició. Els enfocaments poden incloure medicament, vacunes o canvis en l’estil de vida.
- Assajos sobre qualitat de vida, o assajos de cures de suport. Exploren i mesuren maneres de millorar el confort i la qualitat de vida de les persones que tenen una afecció o malaltia.
- Assajos de detecció. Avaluen noves maneres de detectar malalties o afeccions de salut.
- Assajos de tractament. Avaluen nous tractaments, noves combinacions de medicaments o nous enfocaments per a cirurgies o radioteràpia.
Fases dels assajos clínics
Perquè un fàrmac surti al mercat i, per consegüent, sigui considerat un medicament eficaç per a una/es malaltia/es concreta/es, ha de superar una sèrie de fases IMPRESCINDIBLES i OBLIGATÒRIES (de forma pràctica i legalment) i comprovacions
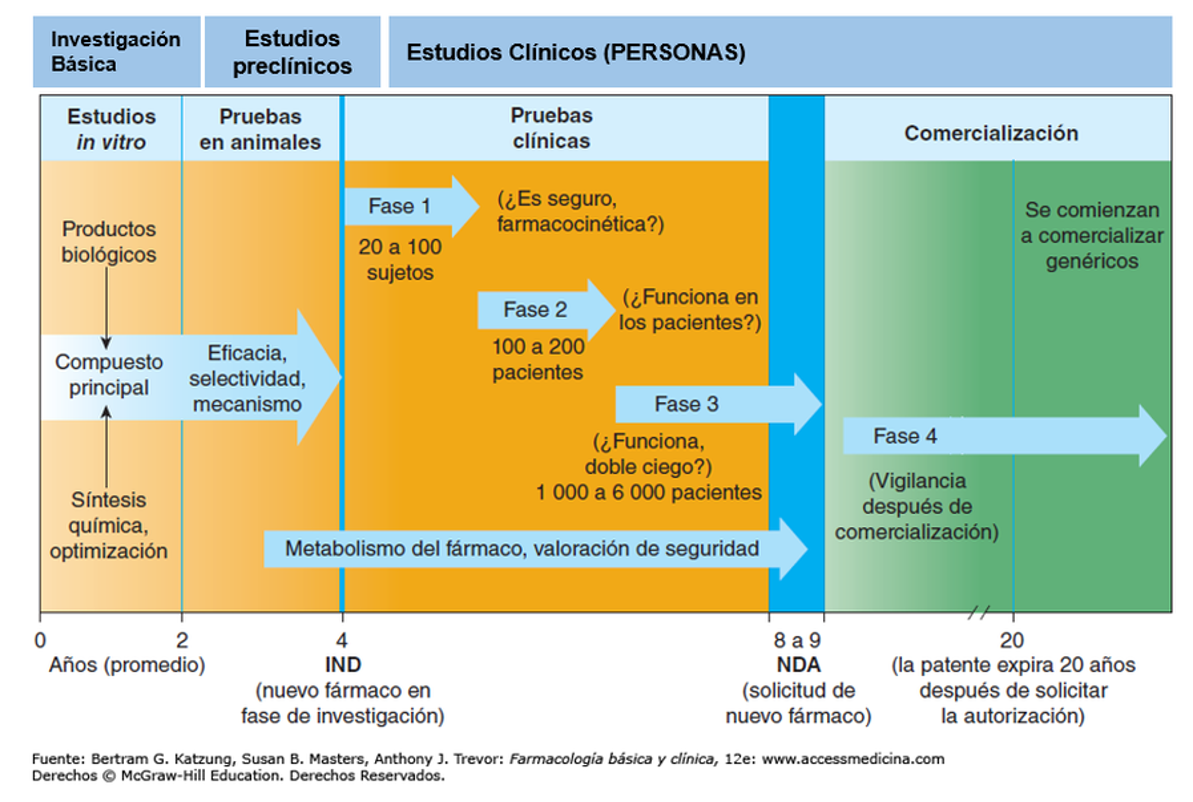
Com es pot comprovar en la gràfica, un medicament pot tenir una fase de proves, comprovacions i vigilància de més de 10 anys. En els estudis in vitro es comprova la seva eficàcia en cèl·lules, després es verifica en models animals i, a posteriori, es realitzen els assajos clínics en persones. Al principi, amb un subgrup molt reduït i, després, en grups més nombrosos. Al seu torn, molts assajos clínics en Fase 3 es realitzen amb “cegament doble”, la qual cosa significa que el pacient no sap si pren el fàrmac testat o el placebo, i el metge tampoc. Tot això amb la finalitat d’evitar qualsevol arbitrarietat.
Cada fase d’un assaig clínic té un propòsit diferent i ajuda els investigadors a respondre a diferents preguntes.
- Assajos de fase I:
 El primer grup de persones inclòs acostuma a ser petit (fins a una dotzena generalment), reben una dosi baixa del tractament i se les observa minuciosament. Si només apareixen efectes secundaris menors, el pròxim grup petit de participants rep una dosi més alta. Aquest procés continua fins que els metges troben la dosi més propensa a funcionar, sempre que es mantingui un nivell acceptable d’efectes secundaris.
El primer grup de persones inclòs acostuma a ser petit (fins a una dotzena generalment), reben una dosi baixa del tractament i se les observa minuciosament. Si només apareixen efectes secundaris menors, el pròxim grup petit de participants rep una dosi més alta. Aquest procés continua fins que els metges troben la dosi més propensa a funcionar, sempre que es mantingui un nivell acceptable d’efectes secundaris.
En aquesta fase la seguretat és la principal prioritat. L’equip d’investigació està pendent de qualsevol efecte secundari greu. Degut al petit nombre de persones en els estudis en fase I, es possible que els efectes secundaris que siguin poc comuns no siguin observat fins després de la inclusió de més participants. Encara que algunes persones es beneficiïn de participar en l’estudi, la resposta que la malaltia tingui davant el tractament no és l’objectiu de la fase 1. Malgrat que comportin un potencial de risc més alt, en tractar-se de persones amb malalties que posen la seva vida en perill, i donada la possibilitat d’algun benefici, els pacients opten en ocasions per participar en la fase 1 quan totes les altres opcions de tractament ja han estat provades sense èxit.
- Assajos de fase II:
 Si en la fase 1 es determina que un nou tractament és segur, llavors es procedeix amb la fase 2 per determinar la seva eficàcia en determinats tipus de patologies, en especial en càncers. El benefici que els metges busquen és variable, pot implicar l’evidència que el tumor cancerós s’ha reduït o desaparegut, o pot implicar que el tumor cancerós no creix (o creix més lentament) durant un període de temps més gran de l’esperat. En alguns estudis, l’objectiu pot ser una millora en la qualitat de vida. Com a norma general, s’espera que rebre un tractament impliqui una expectativa de vida més gran (o millor) a l’esperable de no rebre’l.
Si en la fase 1 es determina que un nou tractament és segur, llavors es procedeix amb la fase 2 per determinar la seva eficàcia en determinats tipus de patologies, en especial en càncers. El benefici que els metges busquen és variable, pot implicar l’evidència que el tumor cancerós s’ha reduït o desaparegut, o pot implicar que el tumor cancerós no creix (o creix més lentament) durant un període de temps més gran de l’esperat. En alguns estudis, l’objectiu pot ser una millora en la qualitat de vida. Com a norma general, s’espera que rebre un tractament impliqui una expectativa de vida més gran (o millor) a l’esperable de no rebre’l.
En la fase II s’inclouen entre 25 i 100 persones amb una mateixa patologia que reben el nou tractament. El tractament s’administra d’acord amb la dosi i el mètode s’hagin determinat com a més segurs i efectius en la fase I de l’estudi. Generalment, en la fase II tots reben la mateixa dosi. No obstant això, en alguns estudis en fase II s’assignen persones de manera aleatòria a grups amb diferents tractaments. En aquests grups és possible que s’administrin diferents dosis o que el tractament s’administri de maneres diferents, per veure quin ofereix el millor balanç de seguretat i eficàcia. En els estudis clínics en fase II, la gran quantitat de pacients tractats permet deduir el nombre d’efectes secundaris que apareixen habitualment. Si prou pacients es beneficien del tractament i els efectes secundaris no van ser molt nocius, llavors es procedeix amb la fase III del estudi clínic.
- Assajos de fase III:
 Els tractaments que han demostrat que funcionen en estudis clínics de fase II, generalment han de superar exitosament una altra fase abans que s’aprovin per al seu ús generalitzat. Els estudis clínics en fase III comparen la seguretat i eficàcia del nou tractament amb el tractament estàndard actual. Ja que els metges encara no saben quin tractament és millor, sovint es trien a l’atzar els participants de l’estudi que rebran el tractament estàndard i els que rebran el tractament nou (assignació aleatòria). Quan és possible, tant el doctor com el pacient desconeixen el tractament que està rebent el pacient. Aquest tipus d’estudi es coneix com a estudi de cegament doble. La majoria dels estudis clínics en fase III inclou un gran nombre de participants, almenys diversos centenars. Generalment, aquests estudis es realitzen en tot el país (i inclús arreu del món) alhora. Aquests estudis acostumen a requerir més temps que els estudis en les fases I i II. En la fase III pot ser que s’incloguin placebos (substàncies sense acció curativa, però amb el mateix aspecte, gust i forma que un medicament vertader, però mai s’utilitzen sols si hi ha disponible un tractament que funciona. Per aquesta raó, una persona que hagi estat assignada de forma aleatòria per rebre un placebo pot rebre també un tractament convencional. De la mateixa manera que amb les altres fases dels estudis clínics, els pacients són examinats minuciosament per identificar efectes secundaris i, en cas que siguin molt problemàtics de controlar, es procedeix amb la discontinuïtat de l’estudi.
Els tractaments que han demostrat que funcionen en estudis clínics de fase II, generalment han de superar exitosament una altra fase abans que s’aprovin per al seu ús generalitzat. Els estudis clínics en fase III comparen la seguretat i eficàcia del nou tractament amb el tractament estàndard actual. Ja que els metges encara no saben quin tractament és millor, sovint es trien a l’atzar els participants de l’estudi que rebran el tractament estàndard i els que rebran el tractament nou (assignació aleatòria). Quan és possible, tant el doctor com el pacient desconeixen el tractament que està rebent el pacient. Aquest tipus d’estudi es coneix com a estudi de cegament doble. La majoria dels estudis clínics en fase III inclou un gran nombre de participants, almenys diversos centenars. Generalment, aquests estudis es realitzen en tot el país (i inclús arreu del món) alhora. Aquests estudis acostumen a requerir més temps que els estudis en les fases I i II. En la fase III pot ser que s’incloguin placebos (substàncies sense acció curativa, però amb el mateix aspecte, gust i forma que un medicament vertader, però mai s’utilitzen sols si hi ha disponible un tractament que funciona. Per aquesta raó, una persona que hagi estat assignada de forma aleatòria per rebre un placebo pot rebre també un tractament convencional. De la mateixa manera que amb les altres fases dels estudis clínics, els pacients són examinats minuciosament per identificar efectes secundaris i, en cas que siguin molt problemàtics de controlar, es procedeix amb la discontinuïtat de l’estudi.
- Assajos de fase IV:
Quan els estudis clínics en fase III (i alguns inclús en fase II) reporten que un medicament nou és més eficaç o segur que el tractament actual, se sotmet a una agència reguladora (com la FDA als EUA o l’EMA a Europa) per a la seva aprovació. Ambdues fan una revisió dels resultats dels estudis clínics i altra informació pertinent. En funció de la revisió, es determina si el tractament és adequat per utilitzar-se en pacients amb la malaltia per a la qual va ser provat. Si s’aprova el seu ús, el tractament generalment es converteix en el tractament estàndard, i els medicaments nous subseqüents pot ser que siguin comparats amb aquest tractament abans que s’aprovin. Si les agències consideren que es requereix més evidència que demostri que els beneficis del nou tractament superen els riscos, pot ser que sol·liciti més informació, o inclús que es realitzin més estudis. Els medicaments aprovats per la FDA o l’EMA sovint es mantenen en observació durant un llarg temps mitjançant els estudis en fase IV. Inclús després d’haver provat un medicament nou en milers de persones, pot ser que no se sàpiguen tots els efectes que el tractament pugui tenir.
L’aprovació per part de la FDA o l’EMA no necessàriament implica la disponibilitat d’un fàrmac en tots els països. L’aprovació per la FDA o l’EMA no necessàriament implica la disponibilitat d’un fàrmac en tots els països. Existeix un procés, lamentablement molt lent i complex, pel qual les autoritats sanitàries de cada país autoritzen la seva utilització, en quines indicacions i el preu de referència. A Espanya això és atorgat per l’Agencia Española del Medicamento y Productos Sanitarios.
L’experiència d’un assaig clínic
Com a participant d’un assaig clínic, és possible que treballeu amb un equip d’atenció mèdica, i potser hàgiu d’anar a un hospital o a un altre lloc. Tot el que passi durant l’experiència es basa en un pla anomenat protocol de l’assaig clínic.
Existeixen organismes rectors, anomenats Juntes de Revisió Institucional (IRB) que aproven els protocols i tenen la responsabilitat de garantir la seguretat dels participants. L’equip d’investigació també actua en funció d’altres normes nacionals i internacionals que protegeixen els participants i ajuden a produir resultats confiables de l’estudi.
Abans d’unir-vos a un assaig clínic, us donaran tota la informació sobre l’estudi, a quins procediments us sotmetreu, quant de temps haureu de dedicar a aspectes de l’estudi i qualsevol altra informació que hàgiu de conèixer. Un cop les vostres preguntes hagin estat respostes i us sentiu còmodes, se us demanarà que doneu el vostre consentiment per participar.
Durant un assaig clínic, és possible que vegeu a metges, infermers, treballadors socials i altres proveïdors d’atenció mèdica que monitoritzaran la vostra salut atentament. És possible que us realitzin més proves i exàmens mèdics dels que us farien si no estiguéssiu participant en un assaig clínic. També és possible que us encarreguin altres tasques, com portar un registre de la vostra salut o completar formularis sobre com us sentiu.
Si decidiu que un assaig no es per a vós, o no desitgeu seguir-hi participant, és important que recordeu que podeu retirar-vos en qualsevol moment. El fet que hi participeu, no influirà en la vostra atenció mèdica habitual.
Enllaços d'interès sobre altres temes relacionats amb els assajos clínics
- Què són les pseudoteràpies? Realitat i perills. Fundació Josep Carreras (contingut en espanyol)
- Què és un assaig clínic? SEOM (Sociedad Española de Oncología Médica)
- Hemotrial. Cercador d’Assajos clínicos de la SEHH (Sociedad Española de Hematología y Hemoterapia)
* D’acord amb la Llei 34/2002 de Serveis de la Societat de la Informació i el Comerç Electrònic (LSSICE), la Fundació Josep Carreras contra la Leucèmia informa que tota la informació mèdica disponible a www.fcarreras.org ha estat revisada i acreditada pel Dr. Enric Carreras Pons, Col·legiat núm. 9438, Barcelona, Doctor en Medicina i Cirurgia, Especialista en Medicina Interna, Especialista en Hematologia i Hemoteràpia i Consultor sènior de la Fundació; i per la Dra. Rocío Parody Porras, Col·legiada núm. 35205, Barcelona, Doctora en Medicina i Cirurgia, Especialista en Hematologia i Hemoteràpia i adscrita a la Direcció mèdica del Registre de Donants de Medul·la Òssia (REDMO) de la Fundació).


