Los ensayos clínicos
Los ensayos clínicos son estudios médicos en los que participan personas sanas o pacientes. Estos ensayos permiten hallar nuevas formas seguras y eficaces para prevenir, detectar o tratar enfermedades.
La información proporcionada en www.fcarreras.org sirve para apoyar, no reemplazar, la relación que existe entre los pacientes/visitantes de este sitio web y su médico.
¿Qué es un ensayo clínico?
 Los ensayos clínicos son una parte fundamental dentro del espectro de investigación médica. Normalmente, la idea de un ensayo clínico suele aparecer en un laboratorio. Cuando los investigadores han evaluado un nuevo tratamiento o procedimiento en el laboratorio y en animales de experimentación, los más prometedores pasan ser considerados para ensayos clínicos. A medida que los estudios pasan una serie de pasos, llamados fases, los investigadores obtienen más información sobre el tratamiento, sus riesgos y su eficacia.
Los ensayos clínicos son una parte fundamental dentro del espectro de investigación médica. Normalmente, la idea de un ensayo clínico suele aparecer en un laboratorio. Cuando los investigadores han evaluado un nuevo tratamiento o procedimiento en el laboratorio y en animales de experimentación, los más prometedores pasan ser considerados para ensayos clínicos. A medida que los estudios pasan una serie de pasos, llamados fases, los investigadores obtienen más información sobre el tratamiento, sus riesgos y su eficacia.
Cada ensayo clínico tiene criterios que describen quiénes pueden participar: niños y/o adultos, pacientes o voluntarios sanos, personas con antecedentes étnicos y raciales que les hacen más proclives a determinadas enfermedades, etc. Todos los ensayos clínicos siguen un plan diseñado cuidadosamente (o protocolo) para proteger la salud y responder a preguntas específicas de la investigación. En el protocolo se describe lo que se hará en las personas incluidas y qué pueden esperar éstas del equipo de investigación. Es importante comprender los riesgos y los beneficios de la participación antes de unirse a un ensayo. Los participantes de los ensayos clínicos también tienen derechos y protecciones.
¿Qué finalidad tienen los ensayos clínicos?
Los ensayos clínicos pueden tener diferentes objetivos que permiten distinguir:
- Ensayos conductuales. Evalúan o comparan maneras de promover cambios de conduta destinados a mejorar la salud.
- Ensayos de diagnóstico. Estudian o comparan pruebas o procedimientos para diagnosticar una enfermedad o afección determinada.
- Ensayos de prevención. Buscan mejores maneras de prevenir una enfermedad en personas que nunca la tuvieron o de prevenir su reaparición. Los enfoques pueden incluir medicamentos, vacunas o cambios en el estilo de vida.
- Ensayos sobre calidad de vida, o ensayos de cuidados de apoyo. Exploran y miden maneras de mejorar el confort y la calidad de vida de las personas que tienen una afección o enfermedad.
- Ensayos de detección. Evalúan nuevas maneras de detectar enfermedades o afecciones de salud.
- Ensayos de tratamiento. Evalúan nuevos tratamientos, nuevas combinaciones de medicamentos o nuevos enfoques para cirugías o radioterapia.
Fases de los ensayos clínicos
Para que un fármaco salga al mercado y, por lo tanto, sea considerado un medicamento eficaz para una/s dolencia/s concretas, requiere superar una serie de fases IMPRESCINDIBLES y OBLIGATORIAS (de forma práctica y legalmente) y comprobaciones
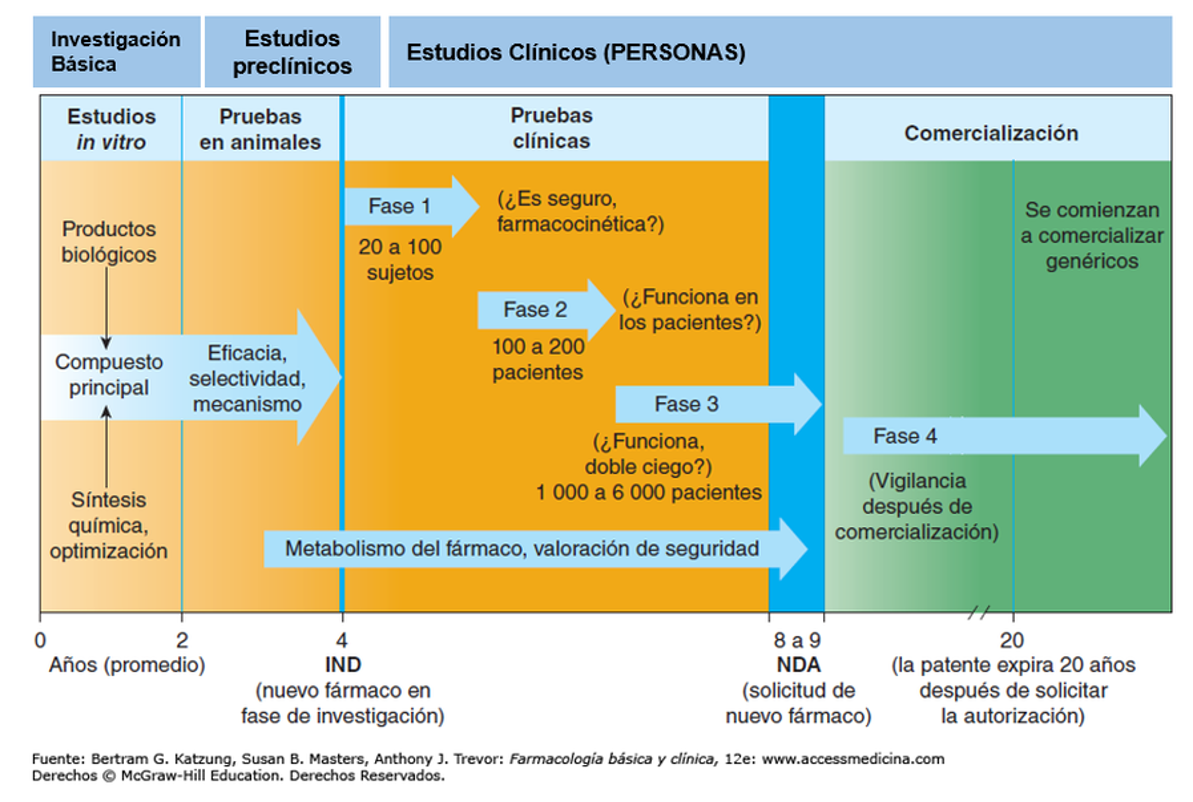
Como se puede comprobar en la gráfica, un medicamento puede tener una fase de pruebas, comprobaciones y vigilancia de más de 10 años. En los estudios in vitro se comprueba su eficacia en células, después se verifica en modelos animales y, a posteriori, se van realizando los ensayos clínicos en personas. Al principio, con un subgrupo muy reducido y, a posteriori, en grupos más numerosos. A su vez, muchos ensayos clínicos en Fase 3, se realizan con “doble ciego”, lo que significa que el paciente no sabe si toma el fármaco testado o placebo y el médico tampoco. Todo ello con el fin de evitar cualquier arbitrariedad.
Cada fase de un ensayo clínico tiene un propósito diferente y ayuda a los investigadores a responder a diferentes preguntas.
- Ensayos de fase I:
 El primer grupo de personas incluido suele ser pequeño (hasta una docena por lo general) y reciben una dosis baja del tratamiento, siendo observadas minuciosamente. Si sólo surgen efectos secundarios menores, el próximo grupo pequeño de participantes recibe una dosis más alta. Este proceso continúa hasta que los médicos encuentran la dosis más propensa a funcionar, mientras se mantiene un nivel aceptable de efectos secundarios.
El primer grupo de personas incluido suele ser pequeño (hasta una docena por lo general) y reciben una dosis baja del tratamiento, siendo observadas minuciosamente. Si sólo surgen efectos secundarios menores, el próximo grupo pequeño de participantes recibe una dosis más alta. Este proceso continúa hasta que los médicos encuentran la dosis más propensa a funcionar, mientras se mantiene un nivel aceptable de efectos secundarios.
En esta fase la seguridad es la principal prioridad. El equipo de investigación está pendiente de cualquier efecto secundario grave. Debido al pequeño número de personas en los estudios en fase I, puede que los efectos secundarios que sean poco comunes no sean observados hasta después de la inclusión de más participantes. Si bien algunas personas se beneficien de participar en el estudio, la respuesta que la enfermedad tenga ante el tratamiento no es el objetivo de la fase 1. Si bien conllevan un potencial mayor de riesgo, al tratarse personas con enfermedades que ponen su vida en peligro, y dada la posibilidad de algún beneficio, los pacientes optan en ocasiones por participar en la fase 1 cuando todas las demás opciones de tratamiento ya han sido probadas sin éxito.
- Ensayos de fase II:
 Si en la fase 1 se determina que un nuevo tratamiento es seguro, entonces se procede con la fase 2 para determinar su eficacia en determinados tipos de patologías, en especial en cánceres. El beneficio que los médicos buscan es variable, puede implicar la evidencia de que el tumor canceroso se ha reducido o desaparecido, o puede implicar que el tumor canceroso no crece (o crece más lentamente) durante un periodo de tiempo mayor de lo esperado. En algunos estudios, puede que el objetivo sea una mejora en la calidad de vida. Como norma general se espera que el recibir tratamiento implique una expectativa de vida mayor (o mejor) a la esperable de no recibirlo.
Si en la fase 1 se determina que un nuevo tratamiento es seguro, entonces se procede con la fase 2 para determinar su eficacia en determinados tipos de patologías, en especial en cánceres. El beneficio que los médicos buscan es variable, puede implicar la evidencia de que el tumor canceroso se ha reducido o desaparecido, o puede implicar que el tumor canceroso no crece (o crece más lentamente) durante un periodo de tiempo mayor de lo esperado. En algunos estudios, puede que el objetivo sea una mejora en la calidad de vida. Como norma general se espera que el recibir tratamiento implique una expectativa de vida mayor (o mejor) a la esperable de no recibirlo.
En la fase II se incluyen entre 25 y 100 personas con una misma patología que reciben el nuevo tratamiento. El tratamiento se administra de acuerdo con la dosis y el método que se determinaron ser los más seguros y efectivos en la fase I del estudio. Por lo general, en la fase II todos reciben la misma dosis. No obstante, en algunos estudios en fase II se asignan a personas de manera aleatoria a grupos con distintos tratamientos. En estos grupos puede que se administren distintas dosis o que el tratamiento se administre de distintas maneras, para ver cuál ofrece el mejor balance de seguridad y eficacia. En los estudios clínicos en fase II, la gran cantidad de pacientes tratados permite deducir el número de efectos secundarios que ocurren de manera común. Si suficientes pacientes se benefician del tratamiento y los efectos secundarios no fueron muy nocivos, entonces se procede con la fase III del estudio clínico.
- Ensayos de fase III:
 Los tratamientos que han demostrado que funcionan en estudios clínicos de fase II por lo general tienen que superar exitosamente otra fase antes de que sean aprobados para su uso generalizado. Los estudios clínicos en fase III comparan la seguridad y eficacia del nuevo tratamiento con el tratamiento estándar actual. Debido a que los médicos aún no conocen que tratamiento es mejor, a menudo se escogen al azar los participantes del estudio que van a recibir el tratamiento estándar y los que van a recibir el tratamiento nuevo (asignación aleatoria). Cuando es posible, tanto el doctor como el paciente desconocen el tratamiento que está recibiendo el paciente. Este tipo de estudios se conoce como estudios de doble ciego. La mayoría de los estudios clínicos en fase III incluyen un gran número de participantes, al menos varios cientos. Por lo general estos estudios se llevan a cabo en todo el país (e incluso alrededor del mundo) al mismo tiempo. Estos estudios suelen tomar más tiempo que los estudios en las fases I y II. En la fase III puede que se incluyan placebos (sustancias que carecen de acción curativa, pero tiene el mismo aspecto, gusto y forma que un medicamento verdadero, pero nunca se usan solos si hay disponible un tratamiento que funciona. Por ello una persona que haya sido asignada de forma aleatoria para recibir un placebo puede también recibir un tratamiento convencional. Al igual que con las otras fases de los estudios clínicos, los pacientes son examinados minuciosamente para identificar efectos secundarios y en caso de que sean muy problemáticos de controlar, se procede con descontinuar la realización del estudio.
Los tratamientos que han demostrado que funcionan en estudios clínicos de fase II por lo general tienen que superar exitosamente otra fase antes de que sean aprobados para su uso generalizado. Los estudios clínicos en fase III comparan la seguridad y eficacia del nuevo tratamiento con el tratamiento estándar actual. Debido a que los médicos aún no conocen que tratamiento es mejor, a menudo se escogen al azar los participantes del estudio que van a recibir el tratamiento estándar y los que van a recibir el tratamiento nuevo (asignación aleatoria). Cuando es posible, tanto el doctor como el paciente desconocen el tratamiento que está recibiendo el paciente. Este tipo de estudios se conoce como estudios de doble ciego. La mayoría de los estudios clínicos en fase III incluyen un gran número de participantes, al menos varios cientos. Por lo general estos estudios se llevan a cabo en todo el país (e incluso alrededor del mundo) al mismo tiempo. Estos estudios suelen tomar más tiempo que los estudios en las fases I y II. En la fase III puede que se incluyan placebos (sustancias que carecen de acción curativa, pero tiene el mismo aspecto, gusto y forma que un medicamento verdadero, pero nunca se usan solos si hay disponible un tratamiento que funciona. Por ello una persona que haya sido asignada de forma aleatoria para recibir un placebo puede también recibir un tratamiento convencional. Al igual que con las otras fases de los estudios clínicos, los pacientes son examinados minuciosamente para identificar efectos secundarios y en caso de que sean muy problemáticos de controlar, se procede con descontinuar la realización del estudio.
- Ensayos de fase IV:
Cuando los estudios clínicos en fase III (y algunos incluso en fase II) reportan que un medicamento nuevo es más eficaz o seguro que el tratamiento actual, se somete a una agencia regulatoria (FDA en USA o de la EMA en Europa) para su aprobación. Ambas hacen una revisión de los resultados de los estudios clínicos y otra información pertinente. En función de la revisión, se determina si el tratamiento es adecuado para usarse en pacientes con la enfermedad para la cual el medicamento fue probado. De aprobarse, el tratamiento generalmente se convierte en el tratamiento estándar, y los medicamentos nuevos subsecuentes puede que sean comparados contra éste antes de que se aprueben. Si las agencias consideran que se requiere de más evidencia que demuestre que los beneficios del nuevo tratamiento superan los riesgos, puede que solicite mayor información, o incluso que se realicen más estudios. Los medicamentos aprobados por la FDA o EMA a menudo se mantienen bajo observación durante un largo tiempo mediante los estudios en fase IV. Incluso tras haber probado un medicamento nuevo en miles de personas, puede que no se sepan todos los efectos que el tratamiento pueda tener.
La aprobación por le FDA o la EMA no necesariamente implica la disponibilidad de un fármaco en todos los países. Existe un proceso, lamentablemente muy lento y complejo, por el que las autoridades sanitarias de cada país autorizan su empleo, en que indicaciones y el precio de referencia. En España esto es otorgado por la Agencia Española del Medicamento y Productos Sanitarios.
La experiencia de un ensayo clínico
Como participante de un ensayo clínico, es posible que trabaje con un equipo de atención médica, y tal vez deba ir a un hospital o a otro lugar. Todo lo que ocurre durante la experiencia se basa en un plan llamado protocolo del ensayo clínico.
Existen organismos rectores, llamados Juntas de Revisión Institucional (IRB) que aprueban los protocolos y tienen la responsabilidad de garantizar la seguridad de los participantes. El equipo de investigación también actúa en función de otras normas nacionales e internacionales que protegen a los participantes y ayudan a producir resultados confiables del estudio.
Antes de que se una a un ensayo clínico, le darán toda la información sobre el estudio, a qué procedimientos se someterá, cuánto tiempo deberá dedicar a aspectos del estudio y cualquier otra información que deba conocer. Una vez que sus preguntas hayan sido respondidas y usted se sienta cómodo, se le pedirá que dé su consentimiento para participar.
Durante un ensayo clínico, es posible que vea a médicos, enfermeros, trabajadores sociales y otros proveedores de atención médica que monitorearán su salud atentamente. Es posible que le realicen más pruebas y exámenes médicos que los que le harían si no estuviera participando en un ensayo clínico. También es posible que le encarguen otras tareas, como llevar un registro de su salud o completar formularios sobre cómo se siente.
Si decide que un ensayo no es para usted, o usted no desea seguir participando, es importante que recuerde que puede retirarse en cualquier momento. El hecho de que participe no influirá en su atención médica habitual.
Enlaces de interés sobre otros temas relacionados con los ensayos clínicos
- ¿Qué son las pseudoterapias? Realidad y peligros. Fundación Josep Carreras
- ¿Qué es un ensayo clínico? SEOM (Sociedad Española de Oncología Médica)
- Hemotrial. Buscador de Ensayos clínicos de la SEHH (Sociedad Española de Hematología y Hemoterapia)
* De acuerdo con la Ley 34/2002 de Servicios de la Sociedad de la Información y el Comercio Electrónico (LSSICE), la Fundación Josep Carreras contra la Leucemia informa que toda la información médica disponible en www.fcarreras.org ha sido revisada y acreditada por el Dr. Enric Carreras Pons, Colegiado nº 9438, Barcelona, Doctor en Medicina y Cirugía, Especialista en Medicina Interna, Especialista en Hematología y Hemoterapia y Consultor senior de la Fundación; y por la Dra. Rocío Parody Porras, Colegiada nº 35205, Barcelona, Doctora en Medicina y Cirugía, Especialista en Hematología y Hemoterapia y adscrita a la Dirección médica del Registro de Donantes de Médula Ósea (REDMO) de la Fundación).


