Hacer las maletas es todo un ritual y un arte para algunas personas. Doblar la ropa de una determinada manera, hacer listas, el neceser… ¿Falta algo? “¿Por qué tengo esta horrible sensación de que me olvido algo?”
Si sonríes es porque lo has vivido
En cambio, cuando te preguntan ‘qué 3 cosas te llevarías a una isla desierta’, todo el mundo lo tiene claro: un cuchillo (es uno de los esenciales más repetidos. Luego a ver cómo lo usarías pero, ¡vale!), una red de pesca gigante (muchos han visto demasiadas ediciones de Supervivientes), una caja de fósforos (claro, lo de los dos palitos, complicado), una hamaca (¡chic@ list@!)…
Pues bien, volviendo a nuestro tema y poniéndonos un poco más serios (lo justo), nos hemos dado cuenta de que muchos pacientes que se van a someter a un trasplante de médula ósea se preguntan qué llevar a una cámara de aislamiento. Cual isla desierta, estas personas van a estar probablemente más de un mes aisladas en una habitación estéril y, a menudo, solos.
“Te da cosa preguntarlo a los médicos porque parece una tontería al lado de todo lo que te está ocurriendo a nivel médico”, explica Esther, paciente de linfoma no Hodgkin de células T anaplásico ALK+ de Valencia que se acaba de someter a un trasplante de médula ósea de su hermano Pau.
“Le pregunté a la Fundación que me aconsejaran qué poner en la maleta del hospital para mi mujer. Por culpa del COVID-19, le iban a hacer el trasplante de médula ósea e iba a estar completamente sola en la cámara de aislamiento. Quería informarme para saber cómo hacer que se sintiese mejor”, comenta Rafa, desde Asturias.
“Yo no me sometí a un trasplante de médula ósea, pero pasaba mucho tiempo aislado por inmunodepresión. Por las mañanas siempre pensaba que echaba en falta el pan tostadito de los desayunos en casa. Y pregunté a mis enfermeras si podía traerme una tostadora pequeñita ”, explica riendo Elías, ex-paciente de leucemia linfoblástica aguda T.
Muchos pacientes, si el hospital no lo ofrece (que muchos sí lo hacen), también preguntan si pueden introducir pequeñas máquinas de deporte (steps por ejemplo) para hacer un poco de ejercicio, etc…
Con la ayuda de Esther nos hemos puesto manos a la obra y hemos elaborado una mini lista que puede ayudarte y distraerte antes del momento de ingresar para trasplante. “La verdad es que me divertí haciendo la maleta y comentando con Alex, del Programa de Experiencia del Paciente de la Fundación Josep Carreras, cosas para llevarme. Fue una manera de desviar la atención del trasplante a algo entretenido en lo que focalizar mi mente. Hacíamos bromas: ‘tienes que prepararte como en las bodas, algo viejo, algo nuevo, algo azul…”. Acabé por eso con una maleta para irme de viaje a las Maldivas”, explica Esther riendo.
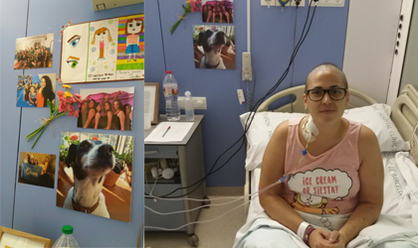
Esther (¡y su maleta!) poco antes de ingresar para trasplante.
Tampoco haremos un Marie Kondo (ella hace que hasta un elefante entre en una maleta de 20×20 sin esfuerzo ), pero vamos a intentar dar buenas ideas que ayuden a distender la situación, resulten útiles y beneficiosas para el paciente. Objetivo: que estas cosas más “triviales” no nos supongan un agobio extra. Ahí va:
MINI LISTA PARA IR A UNA ISLA DESIERTA O, EN SU DEFECTO, A UNA CÁMARA DE AISLAMIENTO PARA UN TRASPLANTE
1. Lleva fotos de familiares y amigos que te animen cuando estés chof.
Claudia, ex paciente de linfoma de Hodgkin, lo tuvo clarísimo cuando ingresó para someterse a un trasplante de médula ósea de su hermano mayor.
Claudia, con la habitación de trasplante decorada con fotos de sus amigos y familiares.
La cámara de aislamiento de Esther.
- Si tienes hijos o sobrinos pequeños, pídeles dibujos.
Los dibujos de Mateo y Álvaro, hijos de Álvaro, ex-paciente de leucemia mieloide aguda trasplantado de un donante de médula ósea alemán, quedaban genial y le daban mucha alegría y fuerza.
- A veces las cámaras de aislamiento no tienen ventanas al exterior (increíble pero cierto). ¿Qué tal un póster chulo que cada vez que lo miremos nos anime a seguir avanzando en esta lucha?
Lo de Paloma, paciente de un síndrome mielodisplásico, ya es una chulada profesional.
- Calendario o agenda. Si te fijas, Paloma también tiene colgado un calendario. Estar en aislamiento en una habitación, es, en cierta manera, perder la noción del espacio y tiempo. Un calendario o agenda nos ayuda a ubicarnos. Esther da un paso más y cada día escribe las experiencias del día en una agenda.
Juanxo, ex paciente de leucemia linfoblástica aguda que se ha sometido a un trasplante de médula ósea y a una inmunoterapia CAR-T comentaba en una ocasión: “Cada día de los cientos que estuve aislado aprendí algo”. Sandra, ex paciente de leucemia aguda trasplantada de un donante en 2018, también lo tenía clarísimo. Escribir es terapéutico.
Sandra, escribiendo en una libreta en la habitación durante su tratamiento.
- El trasplante y el aislamiento van a ser duros físicamente, pero, a menudo, también aburridos. Tampoco nos vamos a encontrar como para leer “Guerra y Paz de Tolstoi” así que, te dejamos algunas ideas:
- librito de Sudokus fáciles
- puzzles
Esther tuvo la fantástica idea de imprimir un puzzle con fotos de sus familiares y amigos. ¡Es una auténtica pasada! De hecho, nuestro colaborador BE PRINT, que ha apadrinado este post, realiza este tipo de puzzles.
– novelas amenas o divertidas. Quizá novela negra no sea la mejor opción Una novela ligerita, agradable y alegre. O libros con temáticas que nos ayuden a animarnos y conectar con nosotros mismos.
Álvaro nos recomienda “El poder del ahora” de Eckart Toole. A él también le fue genial montarse un despachito para “obligarse” a levantarse de la cama e “ir al despacho” a leer, estudiar, trabajar, etc…
-podemos pedir que nos esterilicen unas agujas y lanas de algodón para aprender a hacer ganchillo o papeles de colores para hacer origami, aprender bordado, punto de cruz. Hoy en día con Youtube hay mil posibilidades.
– pintar o dibujar es un recurso brutal. Los mandalas son un símbolo de sanación, totalidad, unión e integración. En muchas culturas, dibujar y colorear mandalas es un ritual espiritual que facilita una “iluminación interior”. En todo caso, entretienen, dan mucha paz y tranquilidad.
Pilar, paciente de leucemia aguda trasplantada en 2020, coloreando en su habitación.
- Móviles, tablets y tecnología. Son un recurso fundamental durante el aislamiento. Hoy en día, la tecnología nos permite una ventana al mundo, al entretenimiento, al aprendizaje. Para que no resulte agobiante o abrumador tanta pantalla, recomendamos pensar una serie de ideas que leer, escuchar, ver o aprender:
– Haz una lista de documentales o pelis chulas para ver. Desde la Fundación, te recomendamos el documental sobre cómo se creó la Fundación: La Fleur.
– Créate una lista de Spotify chula o que tus amigos te hagan una lista sorpresa. En la Fundación te recomendamos la nuestra.
– Que tus amigos te envíen vídeos y fotos a través de redes sociales o whatsapp
– Hazte con un ebook y descarga libros interesantes.
– Bájate APPs chulas en tu tablet. Hoy en día hay app’s de puzles, dibujos, juegos de cartas, juegos de lógica….
Alterna la tecnología con otras actividades y vigila antes de ir a dormir, intenta no conectarte mucho a pantallas en ese momento que luego desvela mucho. ¡Pregunta antes de ingresar si hay wifi gratuito en el hospital!
- Creemos muchísimo en la ciencia y en la actitud del paciente. Nosotros no somos mucho de creencias místicas pero es cierto que a veces los símbolos ayudan a conectar con tu fuerza, energía y ganas. Son muchos los pacientes que, si el trasplante es de un familiar, le piden una pulsera, una medalla, un mini “amuleto”. Y si el donante es anónimo, ponen una banderita del país en la cámara de aislamiento. Es una manera simbólica y divertida de “darle la bienvenida” a la nueva médula .
- Vernos guapos también es importante. A ver, la cámara de aislamiento no es el sitio más glamouroso de la tierra pero verse guapo y arreglarse va bien SIEMPRE. Chicos, haceros con gorras divertidas o pelucas para haceros alguna foto para enviar a vuestros familiares. Seguro que os entretenéis un rato. Chicas, hay mil y una maneras preciosas de ponerse un pañuelo. Te puedes llevar varios pañuelos bonitos en la maleta.
Emi, ex-paciente de linfoma te enseña 7 maneras de ponerte el pañuelo muy originales y favorecedoras:
- Estar todo el día con el pijama del hospital es un rollo. Muchos pacientes traen su propia ropa cómoda y agradable. Algunos pacientes, incluso, abren el lateral dese el cuello hasta la manga y ponen unos botones de clic para que quepa bien el catéter y se pueda abrir y cerrar fácilmente.
8. Habrá días en los que seas más sensible a los ruidos, los olores, sabores, texturas, … por esta misma razón, te recomendamos:
– Durante este período puede que tengas las encías más sensibles e incluso que se te irriten, por eso te sugerimos que lleves un cepillo de dientes de cerdas suaves para que a la hora de cepillarte no se te haga tan molesto. Tienes nuestro Manual de higiene bucodental pñara pacientes trasplantados AQUÍ.
– Toallitas húmedas, habrá algún momento en el que el papel te irrite la piel y lo sientas como una “lija”. Esto también te puede ayudar a refrescarte y sentirte más limpio.
– Para un mejor descanso llevar un antifaz y tapones para los oídos, las luces y ruidos de las maquinas del hospital son constantes y estridentes.
– Puede que sientas los olores de forma más intensa, esto puede ser bueno o malo, por eso te recomendamos que lleves algo con un olor que te agrade mucho como un pañuelo perfumado, tener esto a mano te ayudará a sobrellevar estos momentos desagradables.
– En el caso de disponer de una nevera en la habitación, puedes llevarte cosas refrescantes como polines o refrescos, esto te ayudará a aliviarte posibles molestias en la boca a causa de la mucositis.
9- Llévate también las ganas de hacer algo de ejercicio. ¡Es importante! te recomendamos nuestro Manual de ejercicios de fisioterapia para pacientes hematológicos y trasplantados.
Y, sobre todo, … ¡mucho ánimo!
Encuentra más información sobre el trasplante de médula ósea en nuestra GUÍA DEL TRASPLANTE DE MÉDULA ÓSEA.