The Josep Carreras Institute becomes part of the Cancer Proteome Project, an international initiative for the study of malignant tumors
The Spanish Minister of Science and Innovation, Diana Morant, visited the Josep Carreras Institute on Thursday and announced a grant of one million euros to promote the project
The Josep Carreras Leukaemia Research Institute, led by Dr. Manel Esteller and with the support of the Spanish Ministry of Science and Innovation, is joining the Cancer Proteome Project, a program to promote a line of research dedicated to the characterization of proteins in malignant tumors, which will allow us to learn more about the causes of leukemia
. On the occasion of the entry of the Josep Carreras Institute in the Cancer Proteome Project, the Spanish Minister of Science and Innovation, Diana Morant, visited the research center on Thursday and announced that the Ministry will allocate one million euros to promote this initiative. During her visit, Minister Morant was accompanied by Albert Carreras i Coll and Albert Carreras Pérez, representing the Carreras family, the director of the Institute, Dr. Manel Esteller; the president of the Delegate Committee of the institution, Dr. Evarist Feliu and the acting managing director of the Institute, Ana Garrido. The mayor of Badalona, Rubén Guijarro, has also attended the event.
Over the last twenty years, many efforts have been made to identify the Cancer genome. Decoding the genetic alterations of human tumors has been largely possible thanks to The Cancer Genome Atlas (TCGA), led by the National Cancer Institute (NCI) in the United States, which sequenced the DNA of more than 500 tumor samples derived from every tissue and organ in the body.
However, there was still one key point missing in the research of the cell and molecular cause of cancer: the protein characterization, the product produced from our genetic material. In this respect, the NCI has recently launched the International Proteogenome Consortium (ICPC) program to obtain the profile of all altered proteins in all human tumors, the so-called “Proteome”. The Josep Carreras Leukaemia Research Institute (IJC), led by Dr. Manel Esteller and with the support of the Spanish Ministry of Science and Innovation, has officially joined the consortium with the aim to discover the leukemia proteome.
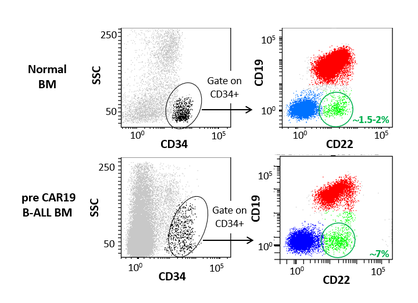
“One in five cancers comes from blood or lymph nodes. Our work in this international program will be to disclose the proteome of leukemia, especially the so-called B-cell acute lymphoblastic leukemia (B-ALL). We will study in detail the altered expression and modification of the protein in this disease in both adult and pediatric populations, as well as their consequences in the clinical management of these patients and the discovery of new treatments against the discovered altered targets”– declares Dr. Manel Esteller, coordinator of the study.
Dr. Henry Rodriguez, Founding Director of the Office of Cancer Clinical Proteomics Research at the National Cancer Institute, and a member of President Joe Biden’s Cancer Research Advisory Council, said, “It is a great pleasure to acknowledge the research work of the Josep Carreras Institute. I am convinced that their aberrant-proteins characterization in leukemia, coupled with data on genome-wide alterations, will be a major breakthrough in personalized cancer medicine that will improve the quality of life and survival of patients.”.