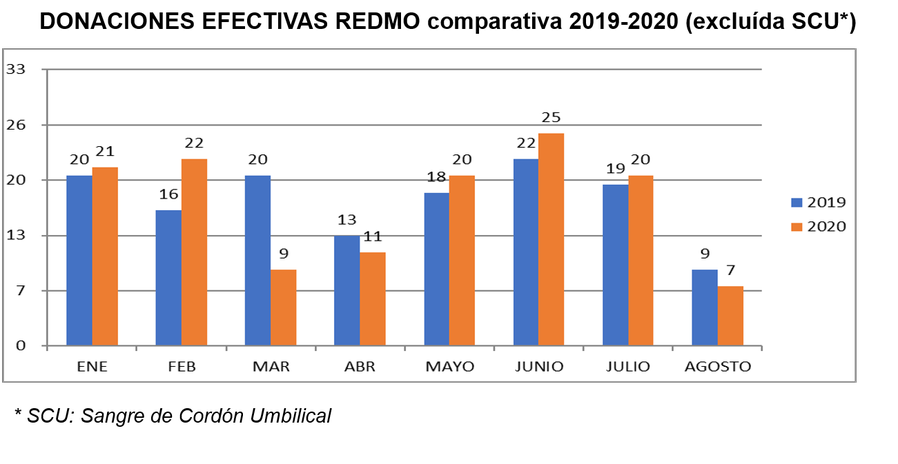
►Dr. Bigas, well-recognized international researcher in the study of the generation and renewal of stem cells and their role in cancer processes, assumes the functions of Deputy Director of Preclinical Research at the Josep Carreras Leukemia Research Institute.
Dr. Bigas has joined as Deputy Director of Preclinical Research at the Josep Carreras Institute, maintaining her relationship with the Hospital del Mar Medical Research Institute (IMIM), where she leads the Stem Cells and Cancer group. The new responsibility that Dr. Bigas assumes will serve to enhance coordination between all groups in the institute that do basic and translational research, seeking synergies between them and optimizing their research, as well as to enhance the existing collaboration between the professionals of our institute and those of the IMIM.
In the last ten years, as head of the Stem Cells and Cancer group, she has studied the molecular and physiological processes of stem cells in different tissues, in order to draw similarities with the appearance and progression of cancerous processes.
In particular, her research focuses on the study of hematopoietic stem cells, responsible for the formation of blood cells, in order to understand the process of leukemia and develop strategies to fight against this disease. Currently, her research group is working on the identification of epigenetic and gene expression profiles, which allow discovering new therapeutic targets not yet exploited clinically.
Research trajectory
Dr. Bigas holds a PhD in cell biology from the University of Barcelona, where she began her research in the generation and renewal of stem cells. During the 1990s, she developed her career as postdoctoral researcher at the Fred Hutchinson Cancer Research Center (Seattle, USA) where she identified the role of the Notch signaling pathway during hematopoietic differentiation. Subsequently, she created her own research group at the Oncology Research Institute (IRO / IDIBELL), where she intensified the study of the Notch, Wnt and NFkB signaling pathways and their molecular mechanisms, involved in the regulation of hematopoietic system and its oncogenic transformation (1997-2008). Since 2009 she has been leading the Stem Cells and Cancer group at the Hospital del Mar Medical Research Institute (IMIM).
Currently, Dr. Bigas is the Scientific Director of CIBERONC (Institute of Health Carlos III) where she coordinates the collaborative research activities in cancer of 50 research groups, distributed throughout the state. She is also a member of the management of the International Society of Experimental Hematology (ISEH) and member the Spanish Association of Hematology and Hemotherapy (AEHH), the European Hematology Association (EHA) and the Spanish Association for Cancer Research (ASEICA). Due to her international relevance, she is reviewer for the European Research Council (ERC) and the Research Councils of Finland and Lithuania. She also occasionally serves as reviewer for the Norwegian Research Council, the Medical Research Council of the United Kingdom, the French National Research Agency and the Israeli Ministry of Science.