Un trasplante de médula ósea. Esta es, de momento, la única posibilidad curativa para muchos pacientes de cánceres de la sangre y otras enfermedades. El concepto “trasplante de médula ósea” es un poco “extraño” para quien sea ajeno al tema, y da pie a algunos errores o malos entendidos. Desde el blog de la Fundación Josep Carreras, hemos querido profundizar un poco más en este asunto. No tanto desde la perspectiva de “cómo se realiza un trasplante de médula ósea hoy en día”, puesto que ya existe mucha información para pacientes y familiares en la Guía del Trasplante de Médula Ósea para pacientes de la Fundación, sino en cual es la historia de estos trasplantes y otras curiosidades.
¿Qué es y qué no es un trasplante de médula ósea?
Lo primero, las palabras trasplante y médula ósea dan pie a confusión. Cuando pensamos en un trasplante, pensamos directamente en la colocación de un órgano sólido de una persona en otro cuerpo de otra persona que está enferma. En este caso, no es un órgano sólido sino sangre, en concreto: células madre de la sangre. Por ello, lo que se hace durante el momento del trasplante es transfundir estas células. Por lo tanto, no, no es una intervención quirúrgica como mucha gente puede pensar. La bolsita de células madre de la sangre se transfunde al paciente a través del catéter que tiene colocado.
Anna, ex paciente de leucemia trasplantada de células madre de la sangre de un donante anónimo localizado por REDMO.
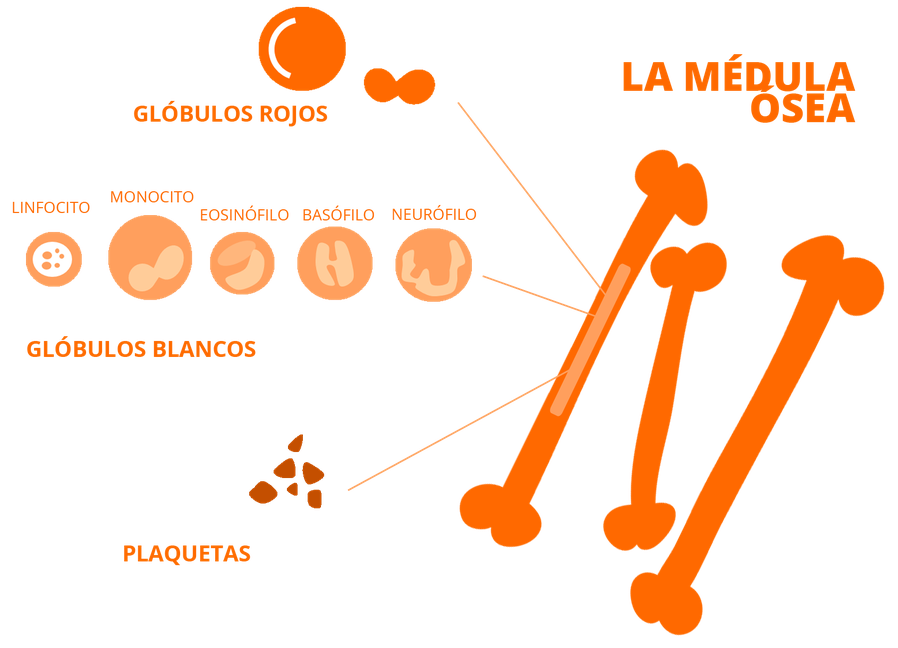
En segundo plano, está el tema de la palabra “médula ósea” que incita a confusión con la “médula espinal”. ¡Nada que ver! La médula ósea no está en la columna vertebral ni tiene nada que ver con el sistema nervioso central de nuestro cuerpo. La médula ósea es el tuétano de los huesos, y allí es dónde se generan las células sanguíneas.
Ahora ya sabemos qué es y qué no es un trasplante de médula ósea. A partir de ahora, lo llamaremos trasplante de células madre de la sangre para ser un poco más claros y concisos, o trasplantes de progenitores hematopoyéticos (TPH). Ahora, veamos a día de hoy quien lo puede necesitar y cuántos trasplantes de médula ósea se llevan a cabo.
¿Quién necesita un trasplante de médula ósea y cuántos se llevan a cabo en España cada año?
Lo primero, no hay un solo tipo de trasplante de células madre de la sangre. Se denominan de diferente manera dependiendo desde dónde se extraen las células.
Básicamente, los TPH pueden ser autólogos (células del mismo paciente) o alogénicos (de un donante sano). Dentro de los trasplantes alogénicos (de donante), el donante puede ser familiar o anónimo no emparentado y, en caso de ser familiar, puede ser 100% idéntico o haploidéntico (la mitad de compatible). Cada enfermedad requiere de un tipo de tratamiento y trasplante específico y tienen mucha importancia, no solo la enfermedad, sino la edad y el estado del paciente. En la web de la Fundación hay información sobre las enfermedades que pueden requerir un trasplante de células madre de la sangre.
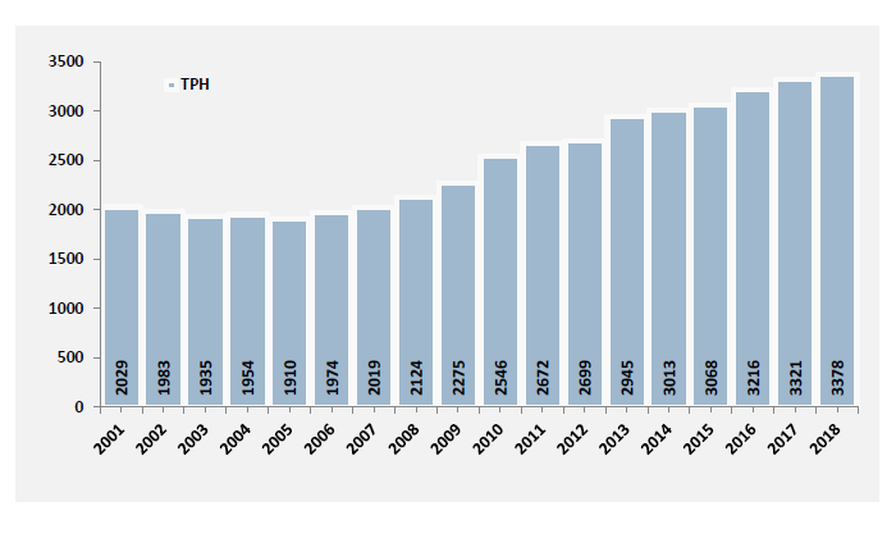
Cada año se realizan en España más de 3.000 TPH según datos de 2017 de la Organización Nacional de Trasplantes, frente a los 477 que se llevaron a cabo en 1990. De hecho, en aquella época, los trasplantes eran siempre autólogos o de familiares compatibles ya que el Registro de Donantes de Médula Ósea (REDMO), no fue creado por la Fundación Josep Carreras hasta 1991. Esta iniciativa surgió porque, en aquel momento, 3 de cada 4 personas que tenían que someterse a un trasplante de médula ósea y no tenían un donante compatible entre sus familiares, no tenían otra oportunidad. No existía un registro de donantes en España.
Noticia del Telediario de La 1 de TVE 13 de junio de 1994 explicando la firma del convenio para el Registro de Donantes de Médula Ósea entre el Ministerio de Sanidad y la Fundación Josep Carreras contra la Leucemia.
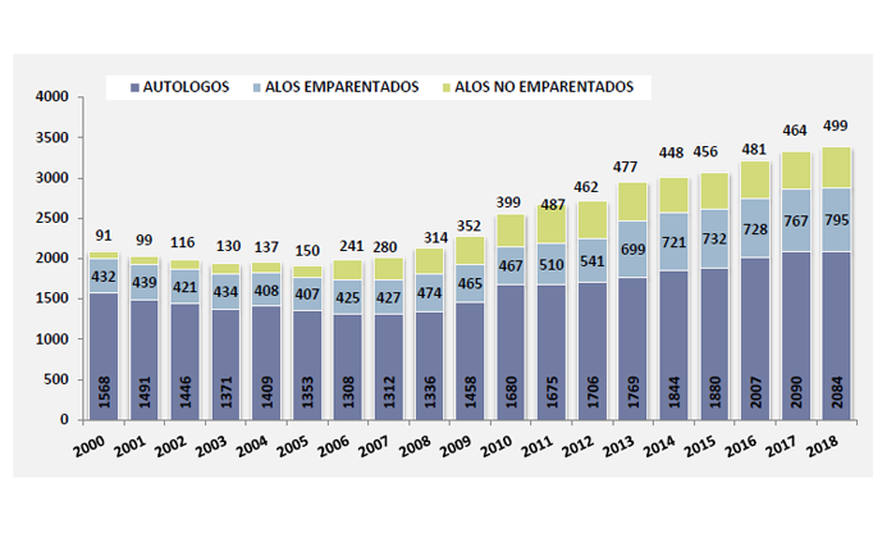
Trasplantes de Progenitores Hematopoyéticos. España 2001-2018 Memoria de Actividad de Trasplante de Progenitores Hematopoyéticos y Terapia Celular 2018 de la Organización Nacional de Trasplantes
De los más de 3.000 TPH que se han llevado a cabo anualmente en los últimos años en España, dos terceras partes son trasplantes autólogos y los demás alogénicos. De estos últimos, menos de la mitad (aprox el 37%) son TPH de donante no emparentado.
Trasplantes de Progenitores Hematopoyéticos por Tipos. España 2001-2018 Memoria de Actividad de Trasplante de Progenitores Hematopoyéticos y Terapia Celular 2018 de la Organización Nacional de Trasplantes
Y, ahora sí, ¿cuál es la historia de los trasplantes de células madre de la sangre?
Pues sí, a alguien se le ocurrió por primera vez en la historia poner la “fábrica de la sangre” (la médula ósea) de otra persona en un paciente cuya médula ósea no funcionaba correctamente. Y ese fue el Prof. Donall E. Thomas. El Dr. Thomas, quien ganó el Premio Nobel de Medicina en 1990, también fue miembro del Patronato de la Fundación Josep Carreras en España y en Estados Unidos y dedicó toda su vida a la lucha contra la leucemia, especialmente en el Hospital Fred Hutchinson de Seattle. También fue uno de los médicos del Sr. Josep Carreras cuando éste enfermó y fue a recibir tratamiento a Seattle.
En 1957, la prestigiosa revista médica The New England Journal of Medicine publicó los resultados de los, desde entonces considerados, seis primeros trasplantes hematopoyéticos (TPH) efectuados en humanos. Los autores administraron por vía intravenosa médula ósea obtenida de crestas ilíacas o costillas de uno o dos donantes vivos, un feto, y un cadáver (¡!!). Dichos trasplantes habían sido realizados en Cooperstown (NY) por el Prof. E. Donnall Thomas. Si bien todos los pacientes fallecieron poco después del procedimiento, se observó que mediante el TPH era posible recuperar la hematopoyesis después de altas dosis de quimio-radioterapia. La hematopoyesis (del griego “hemato-sangre” y “poyesis-creación”) es el proceso de formación, desarrollo y maduración de los elementos de la sangre (eritrocitos, leucocitos y trombocitos (plaquetas) a partir de un precursor celular común e indiferenciado conocido como célula madre hematopoyética multipotente, hemocitoblasto o stem cell (por ello, en inglés se llama bone marrow transplant o stem cell transplant).
Prof. E. Donall Thomas
El Prof. E. Donall Thomas junto al tenor Josep Carreras, recibiendo un galardón.
A nivel anecdótico, es necesario mencionar que 20 años antes ya se habían reportado intentos de tratar enfermedades hematológicas malignas mediante el trasplante de médula ósea fresca, administrada por vía oral, intramuscular1, intravenosa2 o intramedular3, alcanzándose la curación de un paciente con aplasia medular tratado, en 1940, con este último método4.
Los ensayos del Prof. Thomas permitieron conocer aspectos fundamentales de los TPH como el quimerismo5 o la enfermedad secundaria, que en 1959, se denominó Enfermedad injerto contra receptor (EICR).
Poco después, en 1959, Mathé y sus colaboradores publicaron los resultados del trasplante de médula ósea (TMO) en las víctimas de un accidente nuclear y en pacientes con leucemia y Kurnick y su equipo, los primeros TMO autólogos como forma de rescate de la hematopoyesis tras altas dosis de quimio-radioterapia. Sin embargo, si bien en algunos casos existía reconstitución hematopoyética y algunos pacientes alcanzaban remisiones transitorias de su leucemia, no existían largos supervivientes, ya que todos fallecían de infecciones intercurrentes o con manifestaciones compatibles con un EICR.
Estos malos resultados no eran más que la consecuencia del desconocimiento del sistema mayor de histocompatibilidad humano6 que no fue descrito hasta 1958 por Jean Dausset (Premio Nobel en 1980). Es por ello que, hasta 1968, no se realizaron los que se consideran los dos primeros TPH de la “era moderna”, ya que en ambos casos el donante era un hermano HLA-idéntico.
Además de este notable progreso, en la década de los ‘60 se lograron avances en otros aspectos relevantes para el TPH:
– las mejoras en el soporte transfusional (concentrados de plaquetas, hematíes…)
– la profilaxis antibiótica (quimioprofilaxis y medidas de aislamiento)
– el tratamiento de las infecciones (nuevos antibióticos y antifúngicos)
– el mejor conocimiento de los tratamientos de acondicionamiento con ciclofosfamida7, dimetilbusulfán8, busulfán9 e irradiación corporal total fraccionada10.
– la profilaxis de la EICR con metotrexato11, ciclofosfamida12, ciclosporina A13, o ciclosporina más pauta corta de metotrexato14
Gracias a todos esos avances, se logró que el trasplante de células madre de la sangre pudiera aplicarse con garantías de prendimiento de las células madre sanguíneas y posibilidades de controlar la EICR y las complicaciones más frecuentes.
En 1970 ya se habían realizado más de 200 trasplantes a pacientes con leucemias agudas. Allí empezaron a ver que no era lo mismo ni había los mismos resultados si el trasplante era autólogo o alogénico (de un donante). En 1979 se observó que el TPH alogénico comportaba menos recidivas que el TPH autólogo, en especial si el paciente desarrollaba una EICR aguda y/o crónica. Esta observación fue atribuida al efecto antitumoral del injerto, siendo éste un concepto crucial en la evolución del TPH a lo largo de las siguientes décadas.
Fue a mediados de los años ‘70 cuando iniciaron su actividad los grupos de trasplante españoles. Así, el 22 de mayo de 1976, el Dr. Andreu Domingo y su equipo del Hospital de la Santa Creu i Sant Pau de Barcelona, efectuaron el primer TPH síngénico (de gemelos idénticos) y, poco después, el 12 de junio de 1976), los Dres. Ciril Rozman, Albert Grañena y su equipo del Hospital Clínic de Barcelona, el primer trasplante alogénico.
Esta actividad trasplantadora tuvo pronto continuidad en otros grupos de nuestro país. Los centros pioneros del trasplante alogénico en aquellos primeros años fueron, por orden alfabético, el Hospital Clínic de Barcelona (Dr. Albert Grañena), el Hospital de La Fe de Valencia (Dr. Miguel Ángel Sanz), el Hospital de La Princesa de Madrid (Dr. Fernández Rañada), el Hospital Puerta de Hierro de Madrid (Dr. Manuel Nicolás Fernández), el Hospital Ramón y Cajal (Dres. Jesús Odriozola y José García Laraña), el Hospital Reina Sofía de Córdoba (Dr. Antonio Torres) y el Hospital Marqués de Valdecilla de Santander (Dr. Arturo Iriondo),. Mención aparte merece el programa de trasplante infantil desarrollado, a partir de 1983, en el Hospital Materno-Infantil Vall d’Hebron de Barcelona, por el recién fallecido Dr. Juan José Ortega, un profesional de gran excelencia.
La demostración que la eliminación de los linfocitos T del paciente reducía la incidencia y gravedad de la EICR15, principal complicación del TPH, hizo que se idearan diferentes técnicas de eliminación de los linfocitos T tanto ex-vivo (lectinas, elutriación, anticuerpos monoclonales, técnicas de selección CD34+) como in-vivo (globulina antilinfocítica o antitimocítica, anticuerpos monoclonales, ciclofosfamida por trasplante).
Todos estos estudios generaron ingentes cantidades de comunicaciones y publicaciones que, hoy en día y consideradas de forma global, no parecen haber aportado grandes beneficios para los pacientes con hemopatías malignas, ya que siempre que se reduce la incidencia de EICR aumenta la incidencia de recidivas. Por ello, su empleo ha quedado limitado a indicaciones muy precisas, como las enfermedades no neoplásicas, los pacientes con riesgo alto de EICR y bajo de recidiva, y para la práctica de trasplantes haploidénticos por su elevadísimo riesgo de EICR16.
Si bien los primeros trasplantes de progenitores hematopoyéticos de donante no emparentado se efectuaron en los inicios de los años ‘70, disponer de uno de estos donantes fue prácticamente imposible hasta la creación de los registros de donantes. El primer registro se creó en 1974 (Anthony Nolan Foundation) en el Westminster Children’s Hospital del Reino Unido gracias al coraje de la madre de un paciente afecto de una inmunodeficiencia primaria, el Síndrome de Wiscott Aldrich que carecía de donante familiar.
El pequeño Anthony Nolan, junto a su madre, Shirley Nolan.
En España, el tenor Josep Carreras, tras crear la Fundación que lleva su nombre en 1988, creó en 1991 el REDMO (Registro de Donantes de Médula Ósea), registro que el 13 de junio de 1994 fue reconocido como único registro oficial del Estado español por el Ministerio de Sanidad. Con todo, el primer trasplante de células madre de la sangre de donante no emparentado en nuestro país se realizó antes de existir REDMO, el 15 de septiembre de 1988 en el Hospital Clínic de Barcelona. El primer TPH de donante no emparentado realizado a través de REDMO se efectuó en el mismo hospital el 15 de enero de 1992 y la primera donación de un donante de médula ósea voluntario español se realizó el 16 de septiembre de 1994 en el Hospital de la Princesa para un paciente de Australia. Más de 30 años después se dispone de 81 registros activos que reúnen a más de 35 millones de donantes voluntarios en el mundo.
Diversos trabajos evidencian que, actualmente, cuando se emplean donantes con 9/10 o 10/10 identidades con el receptor (compatibilidad HLA), los resultados del TPH de donante no emparentado son equivalentes a los logrados con un hermano HLA-idéntico17. El año 2008 supuso un hito en este campo ya que, por primera vez en la historia, el número de TPH de donante no emparentado registrados por el EBMT (European Society for Blood and Marrow Transplantation) fue mayor que el de TPH de donante familiar, hecho que marcó la tendencia de los siguientes años, dado que el 75% de los pacientes que requieren de un trasplante no disponen de un/a herman@ o familiar histocompatible.
Sin duda, uno de los progresos más notables en el trasplante de células madre de la sangre fue descubrir que tras una adecuada movilización (mediante la administración de factores de crecimiento o tras quimioterapia intensiva) se producía una salida transitoria pero masiva de progenitores hematopoyéticos desde la médula ósea a la sangre circulante (o periférica), pudiendo ser recolectados mediante técnicas de citoaféresis18. Este método simplificaba el procedimiento clásico, al evitar la anestesia general o epidural, y permitía obtener tantos o más progenitores que una aspiración de médula ósea. Además, se observó que con los progenitores de sangre periférica (PSP) se lograba una recuperación hematopoyética e inmune más rápida que con los de médula ósea19. Es por ello que, hoy en día, el 99% de los TPH autólogos y casi el 80% de los TPH de donante se realizan con PSP.
De forma casi simultánea en el tiempo, se observó que la sangre del cordón umbilical de los recién nacidos, obtenida tras el alumbramiento, era muy rica en progenitores hematopoyéticos muy inmaduros20. La celularidad de estas unidades de sangre de cordón umbilical era suficiente para efectuar un trasplante de células madre de la sangre en niños o adolescentes de bajo peso y su mayor inmadurez permitía realizar los TPH empleando unidades con un grado menor de compatibilidad HLA de lo exigido para un donante no familiar.
En 1988, la Dra. Gluckman realizó el primer trasplante de sangre del cordón umbilical entre hermanos en un paciente con anemia de Fanconi en París. En España, el primer trasplante de sangre del cordón umbilical se efectuó en el Hospital Infantil de la Vall d’Hebron de Barcelona el 12 de julio de 1994.
Imagen de una unidad de sangre de cordón umbilical criopreservada.
Con todo, el principal problema de los TPH de sangre de cordón umbilical sigue siendo la lenta recuperación hematopoyética, y la aún más lenta recuperación inmune, hechos que facilitan el desarrollo de todo tipo de infecciones a corto y largo plazo.
Hace 30 años, el TH era una técnica experimental, aplicada a pacientes con enfermedades avanzadas, sin otras opciones terapéuticas, que eran acondicionados con quimio-radioterapias intensivas para lograr el implante de los progenitores de médula ósea procedentes de un hermano HLA compatible. Los resultados obtenidos eran desalentadores ya que la mayoría de pacientes fallecía por complicaciones intercurrentes o recidiva de la enfermedad. Hoy en día, el TH es el tratamiento de elección, o una de las mejores opciones terapéuticas, en muchas enfermedades neoplásicas o no. Puede llevarse a cabo con progenitores de médula ósea, sangre periférica o sangre de cordón umbilical, obtenidos a partir de donantes familiares o no familiares, administrados tras recibir un tratamiento de acondicionamiento ablativo, de intensidad reducida, o no mieloablativo, con unos resultados que mejoran día a día y con unas perspectivas de futuro cada vez más esperanzadoras. Más información sobre el trasplante y los distintos tipos de acondicionamientos en la Guía del Trasplante de Médula Ósea para Pacientes.
Lee o descarga la ‘Guía de trasplante de células madre de la sangre‘ para pacientes y familiares.
Y a día de hoy, ¿qué?
A día de hoy el trasplante de células madre de la sangre es una terapia plenamente consolidada. Desde 1990, en los hospitales españoles se han realizado más de 61.000 trasplantes de médula ósea, de los cuales, más de 6.500 han sido de células madre procedentes de un donante anónimo localizado por el Registro de Donantes de Médula Ósea de la Fundación Josep Carreras. El REDMO de la Fundación ha hecho posibles más de 10.000 trasplantes para pacientes de todo el mundo gracias a las búsquedas de donantes de médula ósea anónimos voluntarios.
Actualmente, en España, existen más de 70 hospitales que realizan esta técnica, de los cuales 32 están autorizados para realizar trasplantes alogénicos de donante no emparentado, con una actividad anual que alcanza los 500 trasplantes.
Estos centros han sabido, no solo adaptarse a los avances técnicos, sino que, bien individualmente, o bien coordinados alrededor de grupos como GETH, PETHEMA, GELTAMO… , han sido verdaderos motores y líderes mundiales en el desarrollo de esta modalidad terapéutica. Tan sólo a título de ejemplo, mencionar los éxitos logrados con los trasplantes alogénicos de sangre periférica, la selección positiva de progenitores CD34+, los trasplantes de intensidad reducida, el trasplante de sangre de cordón umbilical en niños y en adultos, los trasplantes de sangre de cordón con coinfusión de progenitores haploidénticos, los trasplantes autogénico en enfermedades autoinmunes y de depósito, o los trasplantes haploidénticos.
A pesar de todo ello, todavía son muchos los pacientes que no superan un trasplante de células madre de la sangre debido, principalmente, a complicaciones como infecciones o a la enfermedad del injerto contra el receptor. Por ello, desde muchos centros y, nuestra Fundación en especial desde el Instituto de Investigación contra la Leucemia Josep Carreras, estamos investigando mediante proyectos monográficos sobre trasplante.
A modo de ejemplo, el equipo de investigación liderado por el Dr. Enric Carreras estudia el papel que tienen las células endoteliales en las diversas complicaciones observadas en el transcurso del trasplante de progenitores hematopoyéticos.
Las células que recubren la cara interna de los vasos sanguíneos (las venas, las arterias y los capilares) se denominan endoteliales y forman el órgano más grande del cuerpo humano: el endotelio. Este órgano es el responsable de desencadenar las respuestas fisiológicas y adaptativas de nuestro cuerpo. Las células endoteliales, dependiendo de su ubicación, pueden hacer un montón de tareas diferentes.
La superficie de las células endoteliales está recubierta de receptores que interactúan con otras células y moléculas, esto permite al endotelio adaptarse continuamente al ambiente que le rodea. Hoy, sabemos que el endotelio tiene un papel importante en el desarrollo de muchas enfermedades y, por tanto, hay un gran interés en investigar cómo funciona.
El equipo del doctor Enric Carreras
Leyenda
Brown-Sequard CE, 1891
1 Schretzenmayr A, 1937
2 Osgood y cols, 1939
3 Rasjeck y cols 1939
4 Morrison y Samwick, 1940
5 Quimerismo: El análisis del quimerismo permite hacer el seguimiento de la evolución de un trasplante alogénico de progenitores hematopoyéticos, ya sean de médula ósea, sangre o cordón umbilical. Es el método utilizado para hacer el seguimiento y evaluar el riesgo de recaída de un paciente trasplantado. Se basa en la identificación de un marcador molecular que nos permita diferenciar las células del receptor (presencia de marcador) de las células del donante (ausencia del marcador).
6 Sistema mayor de histocompatibilidad
7 Santos y cols, 1964
8 Storb y cols, 1969
9 Tutschka y cols, 1980
10 Thomas y cols, 1982
11 Lochte y cols, 1962
12 Santos y cols, 1966
13 Powels y cols, 1978
14 Deeg y cols, 1982
15 Reisner y cols, 1981
16 Aversa y cols, 1994
17 Yahoub-Agha y cols, 2006
18 To y cols, 1987; Gianni y cols 1989
19 Kessinger y cols, 1988
20 Broxmeyer y cols, 1989