Este dibujo lo hizo Francesc de 11 años. Con él nos explicaba cómo vivía en una cámara de aislamiento de un hospital cuando tenía 4 años y le trataban un linfoma no Hodgkin, un cáncer de la sangre.
Y éste lo dibujó algunos años después. Tenía claro que se necesitaban células armadas hasta los dientes para combatir a las células tumorales.
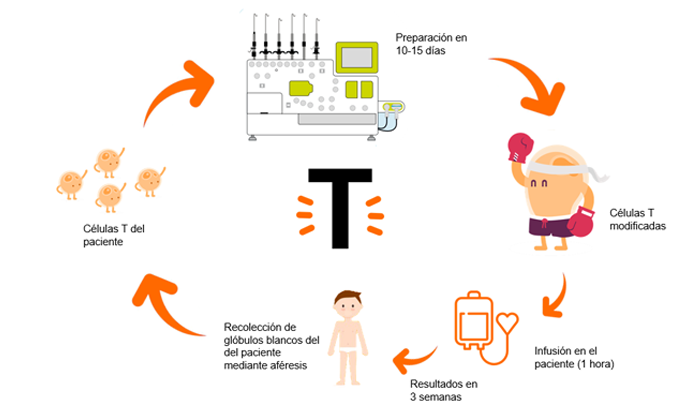
Un CART es exactamente esto: rediseñar, armar, las células “buenas” del organismo de un paciente para combatir un cáncer. Pero no cualquier célula. No. Las seleccionadas son los linfocitos T. Pero, empecemos desde el principio…
►¿Qué es un linfocito T?
Un linfocito T es una célula de nuestro propio organismo, el de todos, pacientes y personas sanas. Los linfocitos son unidades fundamentales de nuestro cuerpo. Son creados por nuestra médula ósea, una substancia que se encuentra dentro de nuestros huesos y contiene las células madre de la sangre que, a posteriori, se convertirán en glóbulos rojos, glóbulos blancos o plaquetas.
Los glóbulos blancos (o leucocitos) son parte del sistema inmunitario de nuestro cuerpo. Nos ayudan a combatir infecciones, elementos extraños (microorganismos, células tumorales o antígenos en general), etc…. Hay 3 grandes tipos de glóbulos blancos: los granulocitos (neutrófilos, eosinófilos y basófilos), los monocitos y los linfocitos (células T y células B).
Los linfocitos T, que se desarrollan en el timo, participan en la respuesta inmunitaria celular** de nuestro organismo; y los linfocitos B, que se desarrollan en la médula ósea y luego migran a diferentes tejidos linfáticos, son los encargados de la respuesta humoral** transformándose en plasmocitos que producen anticuerpos.
Los linfocitos T tienen un receptor especial en la membrana de las células que es específico de ellos y se llama, en inglés, T cell receptor.
► ¿Qué le ocurre a una persona que padece un cáncer de la sangre?
Cada año, más de 6.400 personas son diagnosticadas de leucemia en España, es el cáncer infantil más frecuente (un 30% de las neoplasias en niños).
Además de la leucemia, quizá el cáncer de la sangre más conocido, muchas personas también son diagnosticadas de linfomas, mieloma múltiple, síndromes mielodisplásicos, entre muchos otros
Una persona que padece un cáncer de la sangre como una leucemia o un linfoma, por ejemplo, tiene una médula ósea que no está funcionando correctamente. Por causas todavía desconocidas, las células madre de la sangre empiezan a fabricar en cantidades excesivas una línea celular, por ejemplo, los linfocitos. Estos linfocitos son inmaduros (linfoblastos), se multiplican rápidamente y desplazan a las células normales de la médula ósea, el tejido blando del centro de los huesos dónde se forman las células sanguíneas.
Lo que pretende la quimioterapia es administrar una serie de fármacos muy potentes y que estos erradiquen completamente las células cancerígenas (y, desgraciadamente, también las sanas). Cuando los tratamientos de quimioterapia no son suficientes, bien porque la enfermedad no remite, bien porque reaparece, en algunos cánceres de la sangre, los hematólogos pueden plantear un trasplante de células madre de la sangre (médula ósea, sangre periférica o sangre de cordón umbilical).
Básicamente, un trasplante de células madre de la sangre (llamado, médicamente, trasplante de progenitores hematopoyéticos) consiste en “substituir” la médula ósea dañada del paciente por una nueva. En un trasplante autólogo, se tratan las propias células madre de la sangre del paciente y se le vuelven a infundir y, en un trasplante alogénico, éstas se substituyen por las células de un donante sano. Muchos cánceres de la sangre pueden requerir un trasplante de células madre: las leucemias agudas, los linfomas, el mieloma múltiple o los síndromes mielodisplásicos, entre otros.
► ¿Qué pasa si estos tratamientos no funcionan?
A pesar de los avances tan importantes que se están llevando a cabo en el ámbito de la investigación científica, no todos los pacientes consiguen curarse con los tratamientos anteriormente mencionados.
En general, los niños con leucemia alcanzan altos índices de supervivencia (de más del 85%) y una media de un 50% entre todas las leucemias de los adultos. Pero no todos los cánceres de la sangre tienen el mismo pronóstico y cada paciente reaccionará a los tratamientos de forma diferente.
Por ejemplo, muchos niños afectados de leucemia linfoblástica aguda (el cáncer infantil más frecuente) se recuperarán “solamente” con quimioterapia pero, en el caso de los adultos, y todavía más en el caso de subtipos de la enfermedad de mal pronóstico como la leucemia linfoblástica aguda cromosoma Philadelphia +, muchos necesitarán someterse a un trasplante de células madre de la sangre
Hasta el mes de abril de 2012, los pacientes que recaían tras un trasplante de células madre (o diversos), no tenían más oportunidades de curación.
► ¿Qué ocurrió en abril de 2012?
Tenemos que remontarnos un poco más atrás. El Dr. Carl June es un inmunólogo y oncólogo americano que trabaja en la Universidad de Pensilvania (Filadelfia, Estados Unidos).
El Dr. June empezó su carrera como investigador centrándose sobre todo en el virus de inmunodeficiencia humana (VIH). Su idea era estimular el propio sistema inmunitario de estos pacientes para luchar contra el SIDA. Pero sus prioridades cambiaron cuando a su mujer le diagnosticaron un cáncer de ovario en 1996, cuando tenía 41 años. June intentó desarrollar entonces una inmunoterapia contra el cáncer, pero no logró convencer a ninguna compañía de que invirtiera en el proyecto. Cuando su mujer murió en el 2001, June decidió dedicarse a tiempo completo a la inmunoterapia del cáncer.
En paralelo, había una niña, Emily Whitehead, que padecía leucemia en el Hospital de Niños de Pensilvania. Tras un intenso tratamiento, la enfermedad había reaparecido con más fuerza y estaba en cuidados intensivos sin ninguna oportunidad.
El equipo del Dr. Carl June decidió ofrecerle una terapia experimental que estaban investigando: una inmunoterapia CART. Emily tiene ahora catorce años y es una niña sana que lleva una vida normal.
► ¿Qué es un CART?
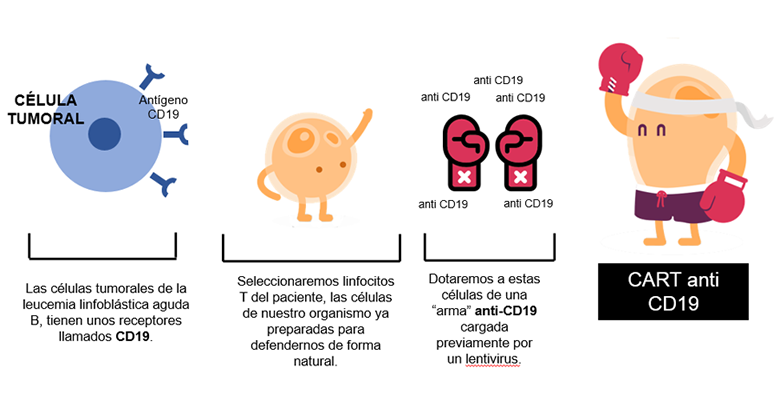
Las células tumorales expresan unos receptores en sus membranas. En cada subtipo de la enfermedad, estas células, y, por lo tanto, los receptores, son distintos y se denominan con “nombres” diferentes. Por ejemplo, los receptores de las células de una leucemia linfoblástica aguda o de algunos linfomas no Hodgkin de tipo B como el linfoma no Hodgkin de células B grandes, se llaman CD19; los del linfoma de Hodgkin o de algunos tipos de linfomas no Hodgkin de tipo T, CD30; o los del mieloma múltiple, CD38. Estos “CD” (cúmulo de diferenciación) son antígenos celulares que se expresan en las membranas de las células tumorales y están formados por cadenas de aminoácidos.
Pero, volvamos a los linfocitos T. Como ya hemos dicho anteriormente, estos están “entrenados” para matar células extrañas del organismo. Podríamos decir que son “naturalmente asesinos”. Pero, en una analogía bélica poco adecuada pero muy descriptiva, podríamos decir que están diseñados biológicamente para “matar moscas a cañonazos”. Erradican muchas células extrañas que se encuentran, pero no todas y no específicamente. Un CART podría definirse, con nuestra analogía, como un calibrado de estas células. Sería coger estos linfocitos T que ya tiene el paciente y saben destruir células, y diseñarlos concretamente para acabar con los receptores concretos de las células tumorales: CD19, CD30, CD38…. según la enfermedad que se esté tratando.
► ¿Cómo se administra un CART?
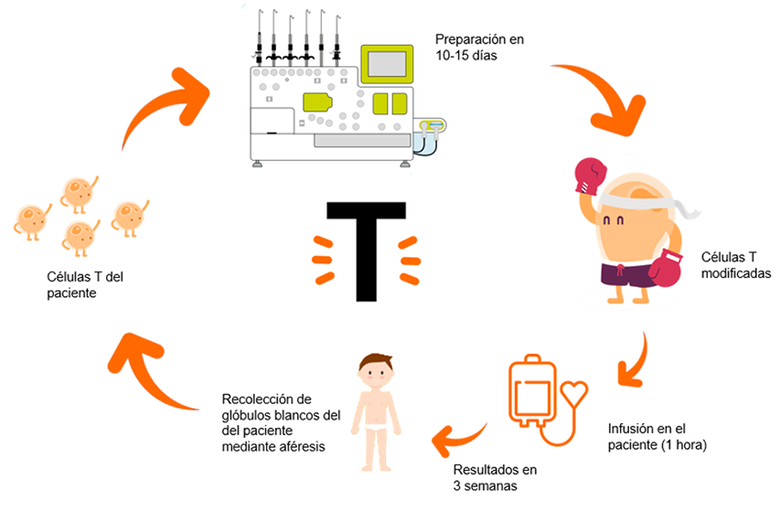
Se extraen los linfocitos T del propio paciente a tratar. Pongamos por caso que es un paciente de leucemia linfoblástica aguda de tipo B (ya hemos comentado anteriormente que las células tumorales de este paciente expresan unos antígenos llamados CD19).
Mediante un lentivirus, un virus cuyo periodo de incubación es muy largo, los inmunólogos infectaran a estos linfocitos T con un virus perpetuo anti-CD19 y los multiplicaran en el laboratorio. Todo ello en una sala blanca. Una sala blanca es una sala especialmente diseñada para obtener bajos niveles de contaminación. Tiene que tener los parámetros ambientales estrictamente controlados: partículas en aire, temperatura, humedad, flujo de aire, presión interior del aire, iluminación…
A posteriori, tras un ciclo de acondicionamiento con quimioterapia, se infundirán estas células anti-CD19 de nuevo en el paciente. De esta manera, en el paciente quedarán unos linfocitos T perpetuos cargados con “armamento anti-CD19” que se llamarán CART anti-CD19.
► ¿Quién hay detrás de los CARTS y cómo llegaron a España?
El primer CART que se llevó a cabo en Estados Unidos fue el CART anti–D19 para leucemia linfoblástica aguda de tipo B infantil, el que se administró a Emily Whitehead. Este ensayo clínico fue posible gracias a una gran farmacéutica, Novartis. Hasta 2016, los tratamientos de inmunoterapia CART que se realizaron en Estados Unidos fueron ensayos clínicos de grandes empresas farmacéuticas. En 2016, Novartis inició el primer ensayo clínico de esta inmunoterapia en algunos hospitales pediátricos de Europa. En nuestro país, los primeros CARTs se realizaron como ensayo clínico en el Hospital Sant Joan de Déu de Barcelona.
Los resultados de estos primeros ensayos clínicos fueron espectaculares y completamente sorprendentes para el mundo de la medicina en general y de la hematología en particular. El 80% de los pacientes estaban libres de la enfermedad un año después de someterse al CART. Es importante destacar que todos estos pacientes eran niños o personas muy jóvenes, todos menores de 25 años, que no habían respondido a ninguno de los tratamientos previos, incluidos trasplantes de células madre de la sangre.
A pesar de ello, la coyuntura de estos ensayos clínicos es complicada. La mayoría de tratamientos CART se suministran a través de una farmacéutica y, por lo tanto, son ensayos clínicos privados, y su coste es muy alto.
En paralelo a estos descubrimientos, algunos grupos de hematólogos e inmunólogos decidieron avanzar para crear unos CARTs llamados “académicos”. Son CARTs impulsados por un hospital universitario, en nuestro país, público, y, por lo tanto, con un coste mucho más asequible. El Hospital Clínic de Barcelona, de la mano del Dr. Álvaro Urbano-Ispizua y del inmunólogo, Dr. Manuel Juan, fueron los primeros en tener a punto un CART académico anti-CD19. Una vez logrados los permisos de la Agencia Española del Medicamento, se empezó el primer ensayo clínico con CART académico anti CD19 en el Hospital Clínic, para adultos, y en el Hospital Sant Joan de Déu para niños. Todos los receptores tenían que ser pacientes con leucemia linfoblástica aguda de tipo B y menores de 25 años. Los resultados también fueron los esperados. En paralelo, en varios hospitales también se continuaron los ensayos clínicos del CART anti-CD19 comercial de la industria farmacéutica).
A pesar de que los primeros resultados fueron apabullantes (>80% de pacientes libres de la enfermedad), los científicos pronto vieron que había que perfeccionar algunos aspectos de esta nueva terapia. En primer lugar, se dieron cuenta que la administración del CART provocaba en el paciente una reacción grave llamada “síndrome de liberación de citoquinas”. El síndrome de liberación de citocinas se presenta por una liberación masiva y rápida en la sangre de las células afectadas por la inmunoterapia. Las citocinas son sustancias que tienen muchas acciones diferentes en el cuerpo. Los signos y síntomas del síndrome de liberación de citocinas incluyen fiebre, náuseas, dolor de cabeza, sarpullidos, latidos cardíacos rápidos, presión arterial baja y dificultad para respirar. La mayoría de los pacientes tienen una reacción leve, pero, a veces, la reacción es grave o pone en peligro la vida. Por ello, se crearon equipos multidisciplinarios para tratar a estos pacientes y, hoy en día, es una complicación que se ha sabido manejar positivamente.
Por otra parte, se vio como algunos pacientes “perdían” los CARTs con el paso del tiempo, perdiendo por supuesto también la reacción inmunológica contra las células tumorales. A pesar de ello, hoy en día el 40-50% de los pacientes que se someten a un CART anti-CD19 siguen libres de la enfermedad pasado un año. Un resultado a mejorar, por supuesto, pero de momento, exitoso.
Actualmente, en nuestro país conviven los ensayos clínicos de CART comerciales y los académicos. No solamente se han desarrollado inmunoterapias CART anti-CD19 para leucemia linfoblástica aguda de tipo B sino también para linfomas no Hodgkin de tipo B como el linfoma difuso de células grandes, por ejemplo. Están ya en curso ensayos clínicos con inmunoterapia anti-CD30 para linfoma de Hodgkin y linfomas no Hodgkin de tipo T y, se están estudiando esta terapia para otras dolencias como la leucemia mieloide aguda. También hay centros españoles que han iniciado ensayos clínicos, tanto académicos como comerciales, con inmunoterapia CART para mieloma múltiple.
► ¿Qué hospitales administran CARTs en España y cómo lo hacen?
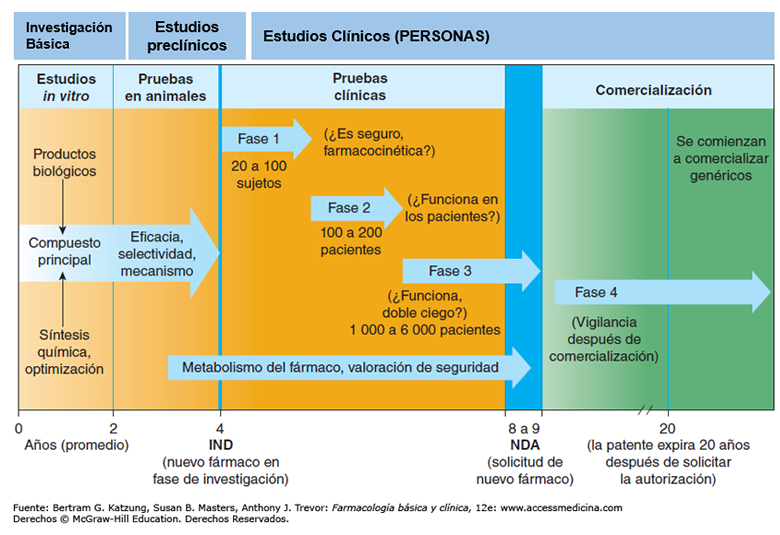
Para explicar qué hospitales administran CARTs y si estos son académicos o comerciales es necesario entender por qué diferentes fases para la aprobación de un ensayo clínico en nuestro país.
Fases IMPRESCINDIBLES (en la práctica y en la legalidad) para producir un tratamiento eficaz
Como se puede leer en la gráfica adjunta, después de los estudios celulares y los estudios en modelos animales, un tratamiento entra en una fase de ensayo clínico denominada Fase I. Para a ello, el equipo debe haber demostrado la efectividad del nuevo tratamiento con 3 pruebas exitosas en modelos animales en condiciones GMP*, haber presentado toda la documentación a la Agencia Española del Medicamento y haber recibido su verificación y autorización. Solo entonces, se podrá llevar a cabo una prueba en unos 10-30 pacientes debidamente seleccionados.
Una vez analizados estos resultados en estos pocos pacientes, se continua o no el ensayo en Fase 2, 3, etc… Son procedimientos muy costosos y complicados.
En el caso del CART anti-CD19, se llevaron a cabo en España todas las pruebas pertinentes y, en diciembre de 2018, la Ministra de Sanidad, Consumo y Bienestar Social, María Luisa Carcedo, anunció la aprobación de la financiación de la primera terapia CART de la industria farmacéutica privada en el Sistema Nacional de Salud (SNS). Se trataba del CART anti-CD19 de Novartis (Kymriah®), indicado para tratar la leucemia linfoblástica aguda (LLA) de células B refractaria, en recaída postrasplante de médula ósea o en segunda o posterior recaída en pacientes pediátricos y adultos jóvenes de hasta 25 años de edad y para la indicación de linfoma B difuso de célula grande (LBDCG), en recaída o refractario tras dos o más líneas de tratamiento sistémico en pacientes adultos. La ministra realizó este anuncio junto a la presentación del Libro blanco de la terapia celular en España, de la Red de Terapia Celular Española del Instituto de Salud Carlos III.
En julio del 2018 obtuvieron una opinión positiva del Ministerio de Sanidad dos medicamentos comerciales CAR-T anti-CD19, y ambos fueron autorizados por la Comisión Europea en agosto de 2018. Estos son:
| Nombre del medicamento | Kymriah® |
| Principio activo | tisagenlecleucel |
| Titular de la autorización | Novartis Europharm Limited |
| Indicación terapéutica |
Kymriah® está indicado en el tratamiento de: • Leucemia linfoblástica aguda (LLA) de células B refractaria, en recaída post trasplante o en segunda o posterior recaída en pacientes pediátricos y adultos jóvenes de hasta 25 años de edad. • Linfoma B difuso de célula grande (LBDCG) en recaída o refractario tras dos o más líneas de tratamiento sistémico en pacientes adultos. |
|
Ubicación centro de manipulación genética |
New Jersey (Estados Unidos) y Leipzig (Alemania) |
|
Congelación de las muestras |
Alemania |
| Nombre del medicamento | Yescarta® |
| Principio activo | axicabtagene ciloleucel |
| Titular de la autorización | Kite Pharma EU B.V. (grupo Gilead) |
| Indicación terapéutica |
Yescarta® está indicado para el tratamiento de pacientes adultos con linfoma B difuso de células grandes (LBDCG) refractario o en recaída y linfoma B primario mediastínico de células grandes (LBPM), después de dos o más líneas de tratamiento sistémico. |
| Ubicación centro de manipulación genética | California (Estaos Unidos) |
| Congelación de las muestras | Países Bajos |
* Tablas e información extraídas del Plan de Abordaje de las Terapias Avanzadas en el Sistema Nacional de Salud: Medicamentos CAR, del Ministerio de Sanidad, Consumo y Bienestar Social a 15 de noviembre de 2018.
El Ministerio, en colaboración con las comunidades autónomas, sociedades científicas y asociaciones de pacientes, acordó un Plan para el abordaje de las terapias avanzadas en el Sistema Nacional de Salud. El objetivo de este Plan es organizar de forma planificada, equitativa, segura y eficiente la utilización de estos medicamentos en unas condiciones que garanticen los estándares de calidad, seguridad y eficacia.
En abril de 2019, el Ministerio presentó la primera Red de centros españoles autorizados para el uso de medicamentos CAR-T en el Sistema Nacional de Salud. Así, «los centros designados para el tratamiento de pacientes adultos con linfoma difuso de células grandes B (LBDCG) recidivante o refractario o con leucemia linfoblástica aguda (LLA) de células B refractaria en el SNS«, actualmente, son:
PACIENTES ADULTOS
- Hospital Clínic de Barcelona
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis) y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
-Autorizado uso asistencial del CART anti CD19 académico ARI-0001 para pacientes adultos (mayores de 25 años) con leucemia linfoblástica aguda de células B CD19+ en recaída o refractarios tras un mínimo de dos líneas de tratamiento o en recaída post-trasplante.
– En evaluación: Realizado ensayo clínico de CART anti BCMA académico CAR-T ARI-0002 para pacientes adultos con mieloma múltiple resistente a los tratamientos habituales (presentado en diciembre de 2021 y pendiente de la autorización de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) para su autorización asistencial.
- Hospital Universitario Gregorio Marañón de Madrid
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
- Hospital Vall d’Hebron de Barcelona
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
- Hospital Universitari i Politècnic La Fe de Valencia
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
- Complejo Asistencial de Salamanca
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
- Hospital Universitario Virgen del Rocío de Sevilla
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
- Hospital Clínico Universitario de Valencia
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
- Hospital de la Santa Creu i Sant Pau de Barcelona
– Autorizado CART comercial anti CD19 para pacientes adultos con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis), y CART comercial anti CD19 para pacientes con linfoma difuso de células B grandes en segunda recaída o resistentes al tratamiento Yescarta® (Kite/Gilead) y Kymriah® (Novartis).
PACIENTES INFANTILES
En el caso de las terapias infantiles, «los centros designados para el tratamiento de pacientes pediátricos con leucemia linfoblástica aguda de células B refractaria» son:
- Hospital del Niño Jesús de Madrid
– Autorizado CART comercial anti CD19 para pacientes infantiles con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis).
- Hospital Sant Joan de Déu de Barcelona
– Autorizado CART comercial anti CD19 para pacientes infantiles con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis).
- Hospital Vall d’Hebron de Barcelona
– Autorizado CART comercial anti CD19 para pacientes infantiles con leucemia linfoblástica aguda B (hasta 25 años) Kymriah® (Novartis).
Centros asistenciales adicionales para ofrecer las inmunoterapias CART en caso de que haya sobrecarga asistencial:
– Institut Català d’Oncología (ICO) Hospital Duran i Reynals de Hospitalet de Llobregat (Barcelona) para adultos
– Institut Català d’Oncología (ICO) Hospital Germans Trias i Pujol de Badalona (Barcelona) para adultos
– Hospital La Paz de Madrid para los casos de pediatría.
El Hospital Universitario de Gran Canaria Dr. Negrín queda también designado como centro con carácter excepcional para la realización de tratamientos con inmunoterapia CART para adultos con leucemia linfoblástica aguda tipo B y linfoma difuso de células B grandes.
► ¿Cuál es el criterio para la selección de pacientes para someterse a una inmunoterapia CART?
Según el Ministerio de Sanidad, en el caso de los pacientes