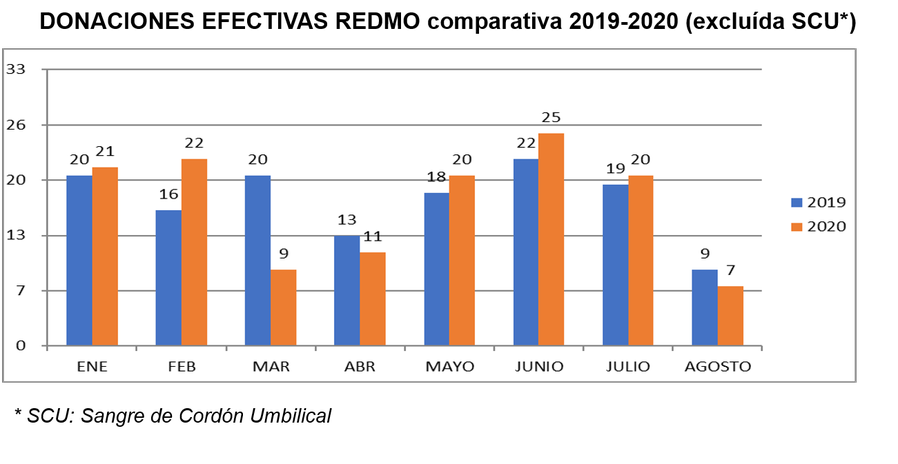
►La doctora Bigas, investigadora de referencia internacional en el estudio de la generación y renovación de células madre y su papel en los procesos cancerosos, asume las funciones de Vicedirectora de Investigación Preclínica en el Instituto de Investigación Contra la Leucemia Josep Carreras.
La Dra. Bigas se ha incorporado como Vicedirectora de Investigación Preclínica del Instituto Josep Carreras, manteniendo su vinculación al Instituto Hospital del Mar de Investigaciones Médicas (IMIM), donde lidera el grupo de Células Madre y Cáncer. La nueva responsabilidad que la Dra. Bigas asume servirá para potenciar la coordinación entre todos los grupos del instituto que realizan investigación básica y traslacional, buscando sinergias entre los mismos y optimizando su investigación, además de para potenciar la ya existente colaboración entre los profesionales de nuestro instituto y los del IMIM.
En los últimos diez años, como jefe del grupo de Células Madre y Cáncer, ha estudiado los procesos moleculares y fisiológicos de las células madre en diferentes tejidos, a fin de trazar similitudes con la aparición y progresión de procesos cancerosos.
En particular, su investigación se centra en el estudio de las células madre hematopoyéticas, encargadas de la formación de las células de la sangre, a fin de comprender el proceso de la leucemia y desarrollar estrategias para luchar contra esta enfermedad.
Actualmente, su grupo de investigación trabaja en la identificación de perfiles epigenéticos y de expresión génica, que permitan descubrir nuevas dianas terapéuticas aún no explotadas clínicamente.
Trayectoria investigadora
La Dr. Bigas es doctora en biología celular por la Universidad de Barcelona, donde inició su investigación en la generación y renovación de células madre. Durante los años 90, desarrolló su carrera como investigadora postdoctoral en el Fred Hutchinson Cancer Research Center (Seattle, EEUU) donde identificó el papel de la vía de señalización Notch durante la diferenciación hematopoyética. Posteriormente, creó su propio grupo de investigación en el Instituto de Investigación Oncológica (IRO / IDIBELL), donde intensificó el estudio de las vías de señalización Notch, Wnt y NFkB y sus mecanismos moleculares implicados en la regulación del sistema hematopoyético y su transformación oncogénica (1997-2008). Desde 2009 lidera el grupo de Células Madre y Cáncer en el Instituto Hospital del Mar de Investigaciones Médicas (IMIM).
En la actualidad, la Dra. Bigas es Directora Científica del CIBERONC (Instituto de Salud Carlos III) donde coordina actividades de investigación colaborativa en cáncer de 50 grupos de investigación distribuidos por todo el estado. Además, es miembro de la dirección de la International Society of Experimental Hematology (ISEH) y miembro de la Asociación Española de Hematología y Hemoterapia (AEHH), la European Hematology Association (EHA) y la Asociación Española de Investigación sobre el Cáncer (ASEICA). Por su relevancia internacional, ejerce de revisora del European Research Council (ERC) y los Consejos de Investigación de Finlandia y Lituania. Además, ejerce ocasionalmente de revisora para el Consejo de Investigación de Noruega, el Medical Research Council del Reino Unido, la Agencia Nacional de Investigación de Francia y el Ministerio de Ciencia de Israel.