El Instituto Josep Carreras entra a formar parte del proyecto Proteoma del Cáncer, una iniciativa internacional para el estudio de los tumores malignos
La ministra de Ciencia e Innovación, Diana Morant, visitó el jueves el Instituto Josep Carreras y anunció una ayuda de un millón de euros para impulsar el proyecto.
El Instituto de Investigación contra la Leucemia Josep Carreras, liderado por el Dr. Manel Esteller y con el apoyo del Ministerio de Ciencia e Innovación, entra a formar parte en el proyecto del Proteoma del Cáncer, un programa para impulsar una línea de investigación dedicada a la caracterización de las proteínas de los tumores malignos, que permitirá conocer más sobre las causas de la leucemia.
Con motivo de la entrada del Instituto Josep Carreras en el proyecto del Proteoma del Cáncer, la ministra de Ciencia e Innovación, Diana Morant, visitó ayer jueves el centro de investigación y anunció que el Ministerio destinará un millón de euros para impulsar esta iniciativa. Durante la visita, la ministra Morant estuvo acompañada por Albert Carreras i Coll y Albert Carreras Pérez, en representación de la familia Carreras, el director del Instituto, el Dr. Manel Esteller; el presidente de la Comisión Delegada de la institución, Dr. Evarist Feliu y la directora gerente en funciones del Instituto, Ana Garrido. También ha asistido el alcalde de Badalona, Rubén Guijarro.
En los últimos veinte años, la comunidad científica ha dedicado grandes esfuerzos en obtener el genoma del cáncer. Descifrar las alteraciones genéticas de los tumores humanos ha sido en buena parte posible gracias al proyecto denominado Atlas del Genoma del Cáncer (TCGA), liderado por el Instituto Nacional del Cáncer (NCI) de Estados Unidos, en el cual se secuenció el ADN de más de 500 muestras de tumores derivados de cada tejido y órgano del cuerpo.
Sin embargo, en esta exploración de las causas celulares y moleculares del cáncer faltaba una pieza importante: la caracterización de las proteínas, el producto producido a partir de nuestro material genético. En este sentido, el NCI lanzó recientemente el Consorcio Internacional de Proteogenoma (ICPC) para obtener precisamente el perfil de todas las proteínas alteradas en todos los tumores humanos, el denominado «Proteoma». Ya es oficial la entrada en dicho consorcio del Instituto Josep Carreras, que tiene como objetivo descubrir el proteoma de la leucemia, en una iniciativa apoyada por el Ministerio de Ciencia e Innovación de España.
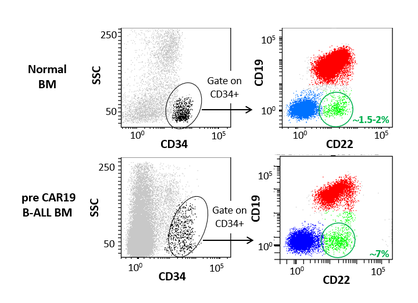
«Uno de cada cinco cánceres es derivado de la sangre o de los ganglios linfáticos. Nuestro trabajo en este programa internacional consistirá en revelar el proteoma de la leucemia, especialmente de la llamada leucemia linfoblástica aguda de tipo B (LLA-B). Estudiaremos en detalle las alteraciones de expresión y modificación de las proteínas en esta enfermedad tanto en población adulta como infantil, así como sus consecuencias en el manejo clínico de estos pacientes y en el descubrimiento de nuevos tratamientos contra las dianas alteradas descubiertas», comenta el Dr. Manel Esteller, coordinador del estudio.
Por su parte, el Dr. Henry Rodríguez, director fundador del Departamento de Investigación en Proteómica Clínica del Cáncer del NCI y miembro del consejo asesor en investigación del cáncer del presidente Joe Biden, declara: «Es una enorme satisfacción reconocer la labor investigadora del Instituto Josep Carreras. Estoy convencido de que su caracterización de las proteínas aberrantes en la leucemia, sumada a los datos de las alteraciones del genoma, supondrá un avance muy importante en la medicina personalizada de cáncer que mejorará la calidad de vida y supervivencia de los pacientes».